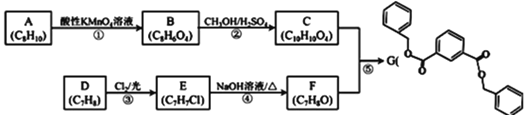
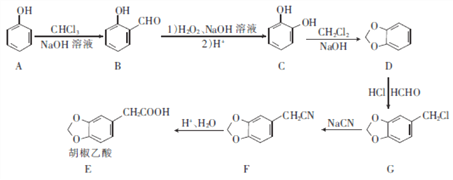
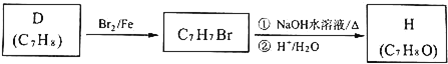题目内容
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为_______________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是___________。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是__________、_____________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是__________、_____________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是__________;在合成硝酸的吸收塔中通入空气的目的是____________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是______________。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的_______%。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:________________________________________________________。
【答案】氧化炉 4NH3+5O2![]() 4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2中化学键断裂 利用余热,节约能源 使NO循环利用,全部转化成HNO3 NH3还原法 53 ①不能与碱性肥料混施;硝酸铵溶液呈酸性;②不能剧烈撞击;硝酸铵易爆炸;③不能在雨水较多的地区使用 硝酸铵吸收性强,易流失。
4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2中化学键断裂 利用余热,节约能源 使NO循环利用,全部转化成HNO3 NH3还原法 53 ①不能与碱性肥料混施;硝酸铵溶液呈酸性;②不能剧烈撞击;硝酸铵易爆炸;③不能在雨水较多的地区使用 硝酸铵吸收性强,易流失。
【解析】
(1)氨气在氧化炉中被催化氧化,B设备的名称是氧化炉;氨气被氧化为NO和水,其反应的方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)N2与H2合成NH3所用的催化剂是铁砂网;图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子;
(3)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2![]() 7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,
7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为![]() ×100%=53%,即制HNO3所用去的NH3的质量占总耗NH3质量的53%;
×100%=53%,即制HNO3所用去的NH3的质量占总耗NH3质量的53%;
(6)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH4NO3![]() N2O↑+2H2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;即①不能与碱性肥料混施;硝酸铵溶液呈酸性;②不能剧烈撞击;硝酸铵易爆炸;③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失。
N2O↑+2H2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;即①不能与碱性肥料混施;硝酸铵溶液呈酸性;②不能剧烈撞击;硝酸铵易爆炸;③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )

A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升