题目内容
8.过渡金属元素钛能形成多种化合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)]和Fe(CO)x等.(1)①基态Fe3+的M层电子排布式为3s23p63d5.
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因+3价铁3d轨道有5个电子,处于半充满状态较稳定.
③对使用含铁配合物检验Fe2+离子的离子方程式3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为立方体.
(4)另一种金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图中丙所示.
若已知该原子半径为d,NA代表阿伏加德罗常数,原子的相对原子质量为M,请回答:
①晶胞中金属原子的配位数为12.
②该晶体的密度为$\frac{\sqrt{2}M}{8{d}^{3}{N}_{A}}$.(用字母表示)

分析 (1)①Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
②因为+3价铁3d轨道有5个电子,处于半充满的稳定结构,而+2价铁3d轨道有6个电子,不是半充满的稳定结构;
③用K3[Fe(CN)6]检验Fe2+离子,反应生成铁氰化亚铁蓝色沉淀;
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;
(3)晶胞中小黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,大黑色球数目为8,则小黑色球为Fe2+、大黑色球为Br-,以上面面心的Fe2+研究,与之最近的Br-有8个,位于上面所在2个晶胞中;
(4)①该金属属于面心立方堆积,以顶点原子研究,与之相邻的原子位于面心,每个顶点原子为12面共用;
②由均摊法可知,晶胞中金属原子数目为4,据此计算晶胞质量,该原子半径为d,面上对角线3个原子相邻,则晶胞棱长为2d×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$d,进而计算晶胞体积,再根据ρ=$\frac{m}{V}$计算晶体体积.
解答 解:(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5 ,则M层电子排布式为:3s23p63d5,
故答案为:3s23p63d5;
②因为+3价铁3d轨道有5个电子,处于半充满的稳定结构,能量较低,而+2价铁3d轨道有6个电子,不是半充满的稳定结构,所以+3价铁的化合物较+2价铁的化合物稳定,
故答案为:+3价铁3d轨道有5个电子,处于半充满状态较稳定;
③用K3[Fe(CN)6]检验Fe2+离子,反应生成铁氰化亚铁蓝色沉淀,反应离子方程式为:3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓,
故答案为:3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓;
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,则8+2x=18,解得x=5,
故答案为:5;
(3)晶胞中小黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,大黑色球数目为8,则小黑色球为Fe2+、大黑色球为Br-,以上面面心的Fe2+研究,与之最近的Br-有8个,位于上面所在上、下2个晶胞中,8个Br-离子为顶点构成的几何体是立方体,
故答案为:立方体;
①该金属属于面心立方堆积,以顶点原子研究,与之相邻的原子位于面心,每个顶点原子为12面共用,故金属原子的配位数为12,
故答案为:12;
②由金属晶胞结构可知,晶胞中金属原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{M}{{N}_{A}}$,该原子半径为d,面上对角线3个原子相邻,则晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,故晶胞体积(2$\sqrt{2}$d)3,则该晶体的密度为 4×$\frac{M}{{N}_{A}}$÷(2$\sqrt{2}$d)3=$\frac{\sqrt{2}M}{8{d}^{3}{N}_{A}}$,
故答案为:$\frac{\sqrt{2}M}{8{d}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、配合物、晶胞结构与计算、亚铁离子检验等,(1)中亚铁离子检验为易错点,只在电化学防护科学探究中出现,难度中等.

| A. |  | B. |  | C. |  | D. |  |
| A. | 电解水若生成33.6L(标准状况)气体时电路中通过的电子数目为2NA | |
| B. | 5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移电子数目为7.5NA | |
| C. | 用2mL5mol/L的FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.01NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2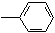 | D. | CH3-C≡C-C≡C-CH3 |
 利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.

 或
或
 碳元素是构成有机物的基础元素.
碳元素是构成有机物的基础元素.