题目内容
5.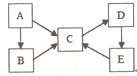 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:(1)若A~E均为化合物,均含有Y元素,A是淡黄色固体;物质的量浓度相等的B、C两溶液中C溶液的pH较小;电解D的水溶液可以生成B和两种气体单质,该反应是工业上生产B的重要反应.
①检验C溶液中含有Y元素的操作方法是用盐酸将铂丝洗净后,放在无色火焰上灼烧至无色,再蘸取碳酸钠溶液放在无色火焰上灼烧,若火焰出现黄色,则说明溶液中有钠元素
②电解D的水溶液时反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH
(2)若A为气体单质,C、D的相对分子质量相差16,0.1moI.L-lE溶液中只有,3种离子,且溶液中的$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{12}}$.则
①A、B、C、D、E中都含有的元素在周期表中的位置为第二周期第ⅤA族,B的电子式为
 .
.②E→C反应的离子方程式为3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
(3)若A为短周期元素组成的固体非金属单质,标况下2.24LC气体通入1L 0.1mo1.L一1的NaOH溶液中,恰好完全反应,测得所得溶液的pH<7,则反应后溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)(OH一除外).
(4)若A为常见金属单质,B、C均为盐,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀.若将金属A的粉末与硝酸钠溶液混合后加入足量的氢氧化钠溶液,只产生一种无色、有刺激性气味的且能使湿润的红色石蕊试纸变蓝色的气体,该反应的离子方程式为8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑.
分析 A、B、C、D、E五种物质均含有同一种元素,
(1)若A~E均为化合物,均含有Y元素,A是淡黄色固体,能发生反应生成B、C,则A是Na2O2,过氧化钠能和水、二氧化碳分别反应生成NaOH、Na2CO3,B、C两溶液在等物质的量浓度时,C 溶液的pH较小,则B是NaOH、C是Na2CO3,电解D的水溶液可以生成B和两种气体单质,该反应是工业上生产B的重要反应,则D为NaCl,根据D→E→C可知,E是NaHCO3;
(2)若A为单质,C、D的相对分子质量相差16,相差一个O原子,0.1mol/L E溶液中只有3种离子,且常温下溶液中的$\frac{c({H}^{+})}{c(OH{\;}^{-})}$=1012,溶液呈强酸性,E为酸,符合条件时,A为N2、B为NH3、C为NO、D为NO2、E为HNO3,再结合物质之间的反应分析解答;
(3)若A为短周期元素组成的固体非金属单质,A能生成C,且C能与氢氧化钠反应,则C一般为氢化物或氧化物,标况下2.24LC即0.1mol气体通入1L 0.1mo1.L-1的NaOH溶液中,恰好完全反应,测得所得溶液的pH<7,则A应为S元素,C为SO2,生成的NaHSO3溶液中亚硫酸氢根离子的水解程度小于电离程度,以电离为主,所以溶液呈酸性,据此答题;
(4)A为金属单质,B、C均属于盐类,D是一种白色沉淀,若B的水溶液呈酸性,C的水溶液呈碱性,则A为Al,B为AlCl3,C为NaAlO2,D为Al(OH)3,据此答题.
解答 解:A、B、C、D、E五种物质均含有同一种元素,
(1)若A~E均为化合物,均含有Y元素,A是淡黄色固体,能发生反应生成B、C,则A是Na2O2,过氧化钠能和水、二氧化碳分别反应生成NaOH、Na2CO3,B、C两溶液在等物质的量浓度时,C 溶液的pH较小,则B是NaOH、C是Na2CO3,电解D的水溶液可以生成B和两种气体单质,该反应是工业上生产B的重要反应,则D为NaCl,Y为钠元素,根据D→E→C可知,E是NaHCO3,
①检验C溶液中含有Y元素的操作方法是用盐酸将铂丝洗净后,放在无色火焰上灼烧至无色,再蘸取碳酸钠溶液放在无色火焰上灼烧,若火焰出现黄色,则说明溶液中有钠元素,
故答案为:用盐酸将铂丝洗净后,放在无色火焰上灼烧至无色,再蘸取碳酸钠溶液放在无色火焰上灼烧,若火焰出现黄色,则说明溶液中有钠元素;
②D为NaCl,电解D的水溶液时反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(2)若A为单质,C、D的相对分子质量相差16,相差一个O原子,0.1mol/L E溶液中只有3种离子,且常温下溶液中的$\frac{c({H}^{+})}{c(OH{\;}^{-})}$=1012,溶液呈强酸性,E为酸,符合条件时,A为N2、B为NH3、C为NO、D为NO2、E为HNO3,
①A、B、C、D、E中都含有的元素为氮元素,在周期表中的位置为第二周期第ⅤA族,B为NH3,B的电子式为 ,
,
故答案为:第二周期第ⅤA族; ;
;
②E→C反应的离子方程式为3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O;
(3)若A为短周期元素组成的固体非金属单质,A能生成C,且C能与氢氧化钠反应,则C一般为氢化物或氧化物,标况下2.24LC即0.1mol气体通入1L 0.1mo1.L-1的NaOH溶液中,恰好完全反应,测得所得溶液的pH<7,则A应为S元素,C为SO2,生成的NaHSO3溶液中亚硫酸氢根离子的水解程度小于电离程度,以电离为主,所以溶液呈酸性,所以反应后溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-);
(4)A为金属单质,B、C均属于盐类,D是一种白色沉淀,若B的水溶液呈酸性,C的水溶液呈碱性,则A为Al,B为AlCl3,C为NaAlO2,D为Al(OH)3,若将金属A的粉末与硝酸钠溶液混合后加入足量的氢氧化钠溶液,只产生一种无色、有刺激性气味的且能使湿润的红色石蕊试纸变蓝色的气体为氨气,该反应的离子方程式为8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑.
点评 本题考查无机物的推断,注意利用信息及转化关系图推断各物质是解答的关键,习题综合性较强,涉及内容较多,题目难度较大.

| A. | 碳酸钠 | B. | 氢氧化镁 | C. | 过氧化钠 | D. | 氧化铝 |
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
| A. | CH3CH2CH2CH3 | B. | CH3-CH=CHCH3 | C. | HC≡C-CH2 | D. | CH3-C≡C-C≡C-CH3 |
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
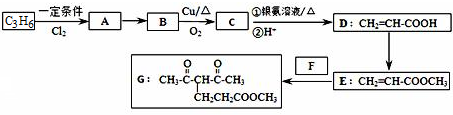

 或
或
 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: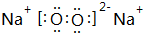 ;
;