题目内容
4.依据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq)设计的原电池如图所示.下列说法正确的是( )
| A. | 银电极是负极 | B. | X电极是锌电极 | ||
| C. | 去掉盐桥电流计指针仍偏转 | D. | Y溶液为AgNO3溶液 |
分析 由方程式2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)可知,反应中Ag+被还原,应为正极反应,则电解质溶液为硝酸银溶液,Cu被氧化,应为原电池负极反应,在装置图中X为Cu,Y为硝酸银溶液,盐桥原电池中金属电极插入含有金属阳离子的盐溶液中,以此解答该题.
解答 解:A、银电极为电池的正极,被还原,故A错误;
B、电极X的材料是铜,为原电池的负极,故B错误;
C、盐桥原电池中金属电极插入含有金属阳离子的盐溶液中,去掉盐桥,不能构成原电池,电流计指针不偏转,故C错误;
D、Y为硝酸银溶液,Ag+被还原,为正极反应,故D正确;
故选:D.
点评 本题考查原电池知识,为高考常见题型及高频考点,侧重于学生的分析能力和基本理论的理解和应用能力,难度不大,注意把握电极反应的判断和电极方程式的书写.

练习册系列答案
相关题目
16.欲配制100mL 1.0mol/LNa2CO3溶液,正确的方法是( )
| A. | 称量10.6 g Na2CO3溶于100 mL水中 | |
| B. | 称量28.6 g Na2CO3•10H2O溶于少量水中,再用水稀释至100 mL | |
| C. | 量取20 mL 5.0 mol/L Na2CO3溶液用水稀释至100 mL | |
| D. | 配制80 mL 1.0 mol/L Na2CO3溶液,则只需要称量8.5 g Na2CO3 |
15.碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途.
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是CO+2MgSO4 $\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3.
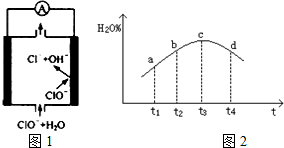
②由MgO制成的Mg可构成“镁-次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(3)某研究小组将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①实验Ⅰ中,前5min的反应速率v(CO2)=0.15mol/(L.min).
②下列能判断实验Ⅱ已经达到平衡状态的是(填写选项序号)ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图2所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.

(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是CO+2MgSO4 $\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3.
②由MgO制成的Mg可构成“镁-次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(3)某研究小组将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
②下列能判断实验Ⅱ已经达到平衡状态的是(填写选项序号)ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图2所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
12.下列实验操作:①用50mL量筒量取5mL蒸馏水;②称量没有腐蚀性固体药品时,把药品放在托盘上称量;③倾倒液体时试剂不对准容器口;④块状药品都要用药匙取用;⑤固体药品用广口瓶保存.其中不正确的是( )
| A. | ①②③④ | B. | ③④ | C. | ②⑤ | D. | ①②④⑤ |
19.采用如图装置和操作,不能达到实验目的是( )
| A. | 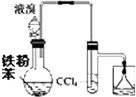 制溴苯并检验HBr | B. |  制乙炔 | ||
| C. | 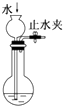 检查装置气密性 | D. |  比较醋酸、碳酸、苯酚酸性强弱 |
9.如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为12mol/L.
现在需要475mL物质的量浓度为0.6mol/L稀盐酸,用上述浓盐酸和蒸馏水配制:
(2)需要量取25 mL上述浓盐酸进行配制.
(3)配制过程中,除需使用烧杯、量筒、玻璃棒外,还需要的仪器是胶头滴管.500mL容量瓶.
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)BCAFED.
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入所选用的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1-2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是BD
A.摇匀后静置,发现液面低于刻线,未做任何处理
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.用量筒量取浓盐酸时俯视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶.
| 盐酸 分子式: 相对分子量:36.5 密度:1.2g/ml HCI质量分数:36.5% |
现在需要475mL物质的量浓度为0.6mol/L稀盐酸,用上述浓盐酸和蒸馏水配制:
(2)需要量取25 mL上述浓盐酸进行配制.
(3)配制过程中,除需使用烧杯、量筒、玻璃棒外,还需要的仪器是胶头滴管.500mL容量瓶.
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)BCAFED.
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入所选用的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1-2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是BD
A.摇匀后静置,发现液面低于刻线,未做任何处理
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.用量筒量取浓盐酸时俯视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶.
13.蒸发操作中必须用到蒸发皿,下列有关蒸发皿的操作中,不正确的是( )
| A. | 将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热 | |
| B. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| C. | 将蒸发皿放置在三脚架上直接用酒精灯火焰加热 | |
| D. | 将灼热的蒸发皿放置一段时间变凉后,放在冷水中冲洗 |
