题目内容
19.采用如图装置和操作,不能达到实验目的是( )| A. | 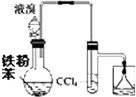 制溴苯并检验HBr | B. |  制乙炔 | ||
| C. | 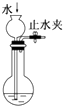 检查装置气密性 | D. |  比较醋酸、碳酸、苯酚酸性强弱 |
分析 A.苯与溴发生取代反应生成HBr,倒扣的漏斗可防止倒吸;
B.碳化钙与水反应生成氢氧化钙微溶,易堵塞多孔塑料板;
C.关闭止水夹,利用长颈漏斗导管中液柱高度检验气密性;
D.醋酸与碳酸钙反应生成二氧化碳,碳酸氢钠除去醋酸,最后烧杯中发生二氧化碳与苯酚的反应生成苯酚.
解答 解:A.苯与溴发生取代反应生成HBr,长导管冷凝回流,倒扣的漏斗可防止倒吸,实验合理,故A正确;
B.碳化钙与水反应生成氢氧化钙微溶,易堵塞多孔塑料板,实验设计不合理,不能继续反应产生气体,故B错误;
C.关闭止水夹,注入水,利用长颈漏斗导管中液柱高度检验气密性,实验设计合理,故C正确;
D.醋酸与碳酸钙反应生成二氧化碳,碳酸氢钠除去醋酸,最后烧杯中发生二氧化碳与苯酚的反应生成苯酚,由强酸制弱酸的原理可知比较醋酸、碳酸、苯酚酸性强弱,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及常见有机物的制备、气密性检查及强酸制取弱酸的反应原理等,侧重物质的性质及实验技能的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7. 如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
 如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入CO2体积为2.24L(标准状况) | |
| B. | NO2转化为N2O4的转换率为20% | |
| C. | 活塞移至C处后,继续通入0.01mol CO2,此时活塞恰好回到D处 | |
| D. | 若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量应大于1.56g |
14.标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是( )
| A. | 体积 ④<①<②<③ | B. | 密度 ①<④<③<② | ||
| C. | 质量 ④<①<③<② | D. | 氢原子数 ②<④<③<① |
4.依据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq)设计的原电池如图所示.下列说法正确的是( )


| A. | 银电极是负极 | B. | X电极是锌电极 | ||
| C. | 去掉盐桥电流计指针仍偏转 | D. | Y溶液为AgNO3溶液 |
8.工业生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1下列判断正确的是( )
| A. | 水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 | |
| D. | 反应物能量总和大于生成物能量总和 |
9.下列说法不正确的是( )
| A. | 丁达尔现象可用于区别溶液与胶体,云、雾、墨水、有色玻璃均能产生丁达尔现象 | |
| B. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团 | |
| C. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| D. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点、溶解度有较大影响 |
 .
. 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量变化如图所示,回答下列问题: