题目内容
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 ( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 ( )
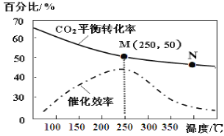
A.M点的正反应速率V正大于N点的逆反应速率V逆
B.若投料比n(H2):n(CO2)=4:1,则图中M点乙烯的体积分数约为5.88%
C.250℃,催化剂对CO2转化率影响最大
D.当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
【答案】B
【解析】
A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、设开始投料n(H2)为4mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,据此列三段式计算;
C、催化剂只影响速率,不影响平衡;
D、根据图象,该反应为放热反应,升高温度,平衡逆向移动。当温度高于250℃,催化剂活性降低。两者间不存在因果关系。
A、图像上的点都处于平衡状态,正逆反应速率相等。温度越高反应速率越快,M点对应的温度为250℃,N点对应的温度为400℃,从温度对速率的影响来说,M点的反应速率小于N点的反应速率。同时M点的催化剂活性高于N点,从催化剂对反应速率的影响来说,M点的反应速率大于N点的反应速率。所以M点的反应速率和N点的反应速率无法确定。故A错误;
B. 若投料比n(H2):n(CO2)=4:1,设投入的H2和CO2分别4mol、1mol,图中M点对应的CO2的平衡转化率为50%,由方程式可知参加反应的H2和CO2分别为1.5mol、0.5mol,生成的乙烯和水蒸气分别为0.25mol、1mol,平衡时H2、CO2、乙烯、水蒸气的物质的量分别为2.5mol、0.5mol、0.25mol、1mol,则乙烯的体积分数为![]() ×100%≈5.88%,故B正确;
×100%≈5.88%,故B正确;
C.催化剂只影响反应速率,不能使平衡发生移动,不影响CO2平衡转化率,故C错误;
D. 当温度高于250℃,升高温度,催化剂的催化效率降低,但不是平衡逆向移动导致催化剂的催化效率降低,催化剂不影响平衡,故D错误。
故选B。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小