题目内容
【题目】中和滴定的误差要求小于0.1%,若用20.00 mL0.2000mol·L-1盐酸滴定20mL0.2000mol·L-1NaOH溶液,则中和滴定曲线中发生突变时的pH范围是(lg2=0.3)( )
A. 4.3~9.7B. 3.7~10.3C. 4.0~10.0D. 无法确定
【答案】C
【解析】
误差要求小于0.1%,则20.00 mL溶液滴定误差为![]() 0.02毫升,此范围内溶液的pH变化称为酸碱滴定的突跃范围,则:
0.02毫升,此范围内溶液的pH变化称为酸碱滴定的突跃范围,则:
盐酸多0.02毫升时,酸过量,c(H+)=![]() =10-4molL-1,pH=4;
=10-4molL-1,pH=4;
则盐酸少0.02毫升时,碱过量,c(OH-)=![]() =10-4molL-1,c(H+)=
=10-4molL-1,c(H+)=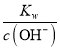 =10-10molL-1,pH=10,即中和滴定曲线中发生突变时的pH范围是4.0~10.0;
=10-10molL-1,pH=10,即中和滴定曲线中发生突变时的pH范围是4.0~10.0;
答案为C。

【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(3)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。



