题目内容
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镲、硒、硅等化学物质。
(1)基态铜原子有________种运动状态不同的电子,核外电子占据最高能层的符号是__________,占据该能层电子的电子云轮廓图形状为____________________;
(2)①硒、硅均能与氢元素形成气态氢化物。则它们形成的组成最简单的氢化物的分子构型分别为______________、_______________。
②若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se___Si(填“>”或“<”)。
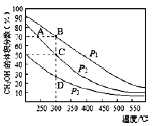
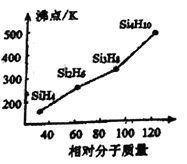
③人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________________________________。
③与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为________________,B与N之间形成_________键。
(4)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。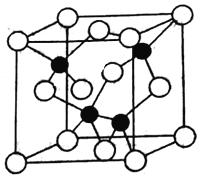
已知砷化镓的晶胞结构如图所示,则砷化镓的化学式为____________,AS和Ga之间的化学键为________和_________。砷化镓密度为ρg·cm-3, Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________(用含有ρ、NA等符号的式子表示)
【答案】 29 N 球形 V 形 正四面体 > 相对分子质量(M)越大,范德华力越大,沸点越高 sp3 配位键 GaAs 共价键 配位键 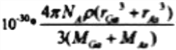 ×100%
×100%
【解析】(1)Cu元素核电荷数为29,所以核外电子排布式为1s22s22p63s23p63d104s1,基态铜原子有29种运动状态不同的电子;核外电子占据最高能层的符号是 N;占据4s能层电子的电子云轮廓图形状为球形;正确答案:29; N ; 球形。
(2)①硒、硅均能与氢元素形成气态氢化物分别为H2Se、SiH4;中心原子硒杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数=2+1/2×(6-2)=4,属于sp3杂化,因为有2对孤电子对,所以分子构型为V形;中心原子硅杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数=4+1/2×(4-4)=4,属于sp3杂化,因为没有孤电子对,所以分子构型为正四面体;正确答案:V 形; 正四面体。
②若“Si—H”中共用电子对偏向氢原子,说明硅显正价;氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;正确答案:>。
③硅烷![]() 都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强;正确答案:相对分子质量(M)越大,范德华力越大,沸点越高。
都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强;正确答案:相对分子质量(M)越大,范德华力越大,沸点越高。
④ BF3·NH3中B原子含有3个![]() 键和1个配位键,所以其价层电子数是4,B原子采取sp3 杂化,该化合物中,B原子提供空轨道、N原子提供孤电子对,所以B、N原子之间形成配位键;正确答案:sp3 ; 配位键。
键和1个配位键,所以其价层电子数是4,B原子采取sp3 杂化,该化合物中,B原子提供空轨道、N原子提供孤电子对,所以B、N原子之间形成配位键;正确答案:sp3 ; 配位键。
(4)根据晶胞结构可知,鎵原子个数为8×1/8+6×1/2=4, 砷原子个数为4,个数比1:1,因此砷化镓的化学式为GaAs;它属于共价化合物,AS和Ga之间的化学键为共价键和配位键;砷化镓密度为ρ gcm-3,根据均摊法计算,As:8×1/8+6×1/2=4, Ga:4×1=4,所以该晶胞中有4个GaAs;故其晶胞中原子所占的体积V1=(4/3πr3As×4+4/3πr3Ga×4)×10-30,晶胞的体积V2=m/ρ= ,故GaAs晶胞中原子的体积占晶胞体积的百分率为V1/V2×100%,将V1、V2带入计算得百分率=
,故GaAs晶胞中原子的体积占晶胞体积的百分率为V1/V2×100%,将V1、V2带入计算得百分率=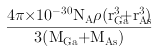 ×100%;正确答案:GaAs ; 共价键; 配位键;
×100%;正确答案:GaAs ; 共价键; 配位键; 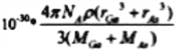 。
。

【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D