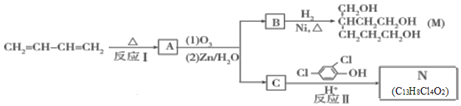
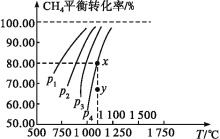
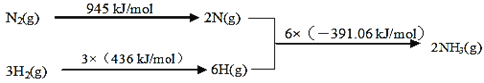
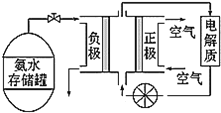
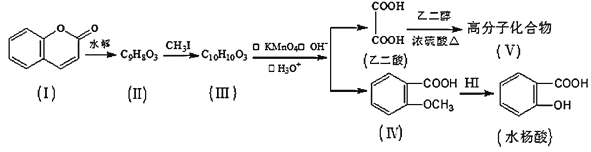
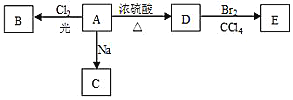
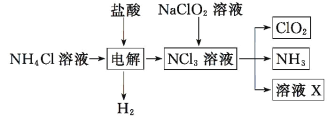
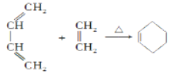题目内容
【题目】将一定的![]() 、
、![]() 合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中![]() 的物质的量( )
的物质的量( )
A.0.01molB.0.02molC.0.03molD.0.04mol
【答案】D
【解析】
由题意知涉及的反应为:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,HCl + NaOH=NaCl + H2O, NaAlO2+ HCl+H2O=Al(OH)3↓+NaCl;当沉淀达最大值时,溶液为NaCl溶液,根据电荷守恒得n(Na+)=n(Cl-),根据原子守恒得n(Na)=n(HCl)=0.04mol;
故选D。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大