题目内容
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
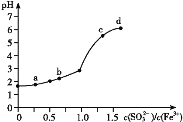
实验发现:
ⅰ.a点溶液澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ⅱ.c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。
下列分析合理的是
A.向a点溶液中滴加BaCl2溶液,无明显现象
B.b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c点溶液中发生的主要反应:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
【答案】C
【解析】
根据i的现象,a点溶液为澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,该沉淀中含有Fe(OH)2,即a点溶液中含有Fe2+,FeCl3溶液中加入Na2SO3溶液,先发生2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,c点和d点溶液中Fe3+和SO32-发生双水解反应产生红褐色沉淀,且生成H2SO3,因此无气体产生,然后据此分析;
根据i的现象,a点溶液为澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,该沉淀中含有Fe(OH)2,即a点溶液中含有Fe2+,FeCl3溶液中加入Na2SO3溶液,先发生2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,c点和d点溶液中Fe3+和SO32-发生双水解反应产生红褐色沉淀,且生成H2SO3,因此无气体产生,取上层清液滴加NaOH溶液,无明显现象,是因为NaOH与H2SO3反应,滴加KSCN溶液显红色,说明溶液中含有Fe3+,
A、a点处溶液中含有SO42-,加入BaCl2,会产生BaSO4白色沉淀,故A错误;
B、pH升高说明溶液c(H+)减小,原因是c(SO32-)增大,水解程度增大,按照给出方程式,生成H+,溶液c(H+)增大,溶液的pH应减小,不会增大,故B错误;
C、c点溶液中Fe3+和SO32-发生双水解反应,离子方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3,故C正确;
D、溶液变红后滴加NaOH会消耗溶液中的Fe3+,因此红色应变浅,故D错误;
答案为C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案