题目内容
【题目】下列判断正确的是
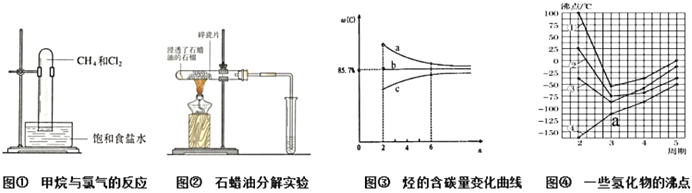
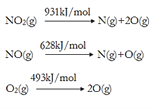
A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
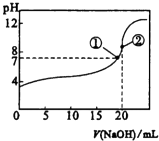
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
【答案】B
【解析】A、CH4要全部变成CCl4,1mol CH4需要4mol Cl2,故A错误;B、石蜡油分解的实验中碎瓷片的作用是催化剂,而蒸馏时碎瓷片的作用是防止暴沸,故B正确;C、随碳原子数增加,烷烃的分子通式为:CnH2n+2,含碳量逐渐增大,烯烃的分子通式为CnH2n,含碳量不变,炔烃的分子通式为:CnH2n-2,含碳量逐渐减小,故C错误;D、图④中点a在4号线上,4号线的沸点逐渐增大,是第IVA元素氢化物的沸点,a代表的物质是SiH4,故D错误;故选B。

练习册系列答案
相关题目