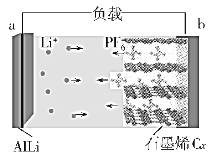
��Ŀ����
����Ŀ����������Ҫ�ĵ��ʣ��Dz������Ļ���Ʒ֮һ����ϳ�ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g)�� ijͬѧΪ��̽��������������Ӧ���ɰ�������һ���¡������ܱ������г���1 mol N2��3 mol H2��Ϸ������з�Ӧ�����ж���1mol H2��Ҫ����436 kJ������������1 mol N2��Ҫ����945 kJ������������1 mol N-H������391 kJ��������
2NH3(g)�� ijͬѧΪ��̽��������������Ӧ���ɰ�������һ���¡������ܱ������г���1 mol N2��3 mol H2��Ϸ������з�Ӧ�����ж���1mol H2��Ҫ����436 kJ������������1 mol N2��Ҫ����945 kJ������������1 mol N-H������391 kJ��������
(1)д��NH3�ĵ���ʽ___________________��
(2)�÷�Ӧ________(����ա��ų���)����______________��
(3)����Ӧ�ﵽƽ��ʱ��N2��H2��ת����֮��Ϊ____________��
���𰸡�![]() �ų� 93kJ 1:1
�ų� 93kJ 1:1
��������
(1)NH3��ÿ����͵�����һ�Ե��ӣ����й¶Ե��ӡ�
(2)���㷴Ӧ�ϼ����յ������ͳɼ��ų������������߱Ƚϡ�
(3)�������֮�ȵ��ڼ���ϵ��֮��ʱ������Ӧ�ﵽƽ��ʱ��N2��H2��ת������ȡ�
(1) NH3��ÿ����͵�����һ�Ե��ӣ����й¶Ե��ӣ����NH3�ĵ���ʽ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�÷�Ӧ�ϼ����յ�����Ϊ436 kJ ��3 + 945 kJ = 2253 kJ���ɼ��ų�������Ϊ391 kJ ��6 = 2346 kJ���ɼ��ų����������ڶϼ����յ���������˷�Ӧ�Ƿų�����2346 kJ 2253 kJ = 93 kJ���ʴ�Ϊ���ų���93 kJ��
(3)�������֮�ȵ��ڼ���ϵ��֮��ʱ������Ӧ�ﵽƽ��ʱ��N2��H2��ת������ȣ����N2��H2��ת����֮��Ϊ1:1���ʴ�Ϊ��1:1��

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ�~���ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� |
��1������ЩԪ���У���ѧ��������õ�Ԫ�ص�ԭ�ӽṹʾ��ͼΪ___���γɵĵ����ǰ뵼�����___����Ԫ�����ƣ���
��2��������γɵĻ�����ĵ���ʽΪ___��������γɵ��������ĽṹʽΪ___��
��3
��4����̬�⻯�����ȶ�����___���ѧʽ�����ڡ��ۡ����ԭ�Ӱ뾶��С��__�����ط��ţ���
��5��������γɵĻ����������___���������ӻ��������������ۻ������������þ�������___���壨������������������������ԭ��������
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������й����ӷ���ʽ��������ȷ����( )
��֪ | ���� | |
A | ��Fe����CuSO4��Һ��Fe+Cu2+=Cu+Fe2+ | ��Na���뵽CuSO4��Һ��2Na+Cu2+=Cu+2Na+ |
B | ��Ca(ClO)2��Һ��ͨ������CO2 Ca2++2ClO-+CO2+H2O=CaCO3��+2HClO | ��Ca(ClO)2��Һ��ͨ������SO2 Ca2++2ClO-+SO2+H2O=CaSO3��+2HClO |
C | �ö��Ե缫���NaCl��Һ 2Cl-+2H2O | �ö��Ե缫���MgBr2��Һ 2Br-+2H2O |
D | ϡ������NaOH��Һ��Ӧ������ H++OH-=H2O | ϡHNO3��Ba(OH)2��Һ��Ӧ������ H++OH-=H2O |
A.AB.BC.CD.D