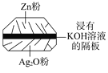
题目内容
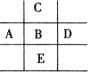
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请回答下列问题:
(1)写出A元素的最高价氧化物的电子式_____________。
(2)B元素在周期表中的位置为_____________。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______________。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程______________。
【答案】![]() 第二周期第ⅥA族 离子键、非极性共价键(或共价键) SO2+Cl2+2H2O=H2SO4+2HCl
第二周期第ⅥA族 离子键、非极性共价键(或共价键) SO2+Cl2+2H2O=H2SO4+2HCl ![]()
【解析】
A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为C元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,则B元素表现为-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na元素;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl元素,据此答题。
由分析可知:A为C元素,B为O元素,C为Na元素,D为S元素,E为Cl元素。
(1)A为C元素,C的最高价氧化物是CO2,含有极性键,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)B为O元素,位于元素周期表的第二周期第ⅥA族,故答案为:第二周期第ⅥA族。
(3)B为O元素、C为Na元素,钠在氧气中燃烧生成过氧化钠,含有离子键和非极性共价键,故答案为:离子键、非极性共价键(或共价键)。
(4)D为S元素、E为Cl元素,硫的低价氧化物是SO2具有还原性,氯水具有氧化性,二者发生氧化还原反应,生成硫酸和氯化氢,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:SO2+Cl2+2H2O=H2SO4+2HCl。
(5)C为Na元素、D为S元素,Na和S形成的2∶1的化合物是Na2S,是由离子键形成的离子化合物,用电子式表示该化合物的形成过程为:![]() ,
,
故答案为:![]() 。
。

 备战中考寒假系列答案
备战中考寒假系列答案