题目内容
13.下列物质中标*号的原子为sp3杂化的是( )| A. | $\stackrel{+}{C}$H20 | B. | $\stackrel{+}{N}$H3 | C. | $\stackrel{+}{B}$F3 | D. |  |
分析 中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:A.CH2O分子分子中碳原子含有3个σ键和1个π键,所以C原子采用sp2杂化,故A错误;
B.氨气分子中氮原子价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以N原子采用sp3杂化,故B正确;
C.BF3中B原子价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,所以B原子采用sp2杂化,故C错误;
D.苯分子中碳原子含有3个σ键和1个π键,所以碳原子采用sp2杂化,故D错误;
故选B.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,明确孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,难度中等.

练习册系列答案
相关题目
4.A、B、C、D、E五种物质均是由两种离子组成,它们均可溶于水并完全电离,电离出的所有离子如下表所示:
(1)某同学通过比较分析,认为无需检验就可判断出其中必有的两种物质是Na2CO3、Ba(OH)2 (填化学式);若将此两种物质记为A和B,含X的物质记为C,当C的溶液与B的溶液混合时,产生红褐色沉淀和无色无味的气体;当C的溶液与A的溶液混合时也产生沉淀,向该沉淀中滴入过量的稀HNO3时,沉淀部分溶解,但最后留下白色的固
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
| 阳离子 | Na+、Al3+、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、OH-、NO3-、CO32-、X |
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
1.下列实验操作或描述中错误的是( )
| A. | 将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 | |
| B. | 溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
8.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60g丙醇存在的共价键总数为10 NA | |
| B. | 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 7.2g新戊烷与异戊烷的混合物中所含极性共价键的数目为1.2NA | |
| D. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
18.下列有关实验操作中合理的是( )
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
5.下列物质中不存在氢键的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 苯酚 | D. | 苯 |
2.某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是( )
| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
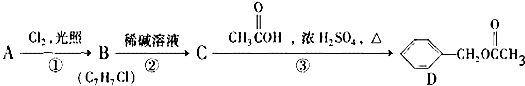
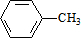 ,C的名称:苯甲醇.
,C的名称:苯甲醇. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$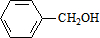 +NaCl.
+NaCl. .
. .
.