题目内容
(10分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)写出下列元素的元素名称:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是______________________。
(1)碳 氧 硅 钠 (各1分) (2)H2O>CH4>SiH4 (2分)
(3)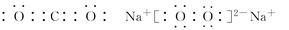 (各1分)
(各1分)
(4)2CO2+2Na2O2=2Na2CO3+O2 (2分)
解析试题分析:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: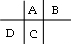 ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素,C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,则
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素,C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,则
(1)根据以上分析可知四种元素名称分别为碳、氧、硅、钠。
(2)非金属性越强,氢化物的稳定性越强,非金属性是O>C>Si,所以氢化物的稳定性由大而小的顺序是H2O>CH4>SiH4。
(3)碳与氧形成的三原子分子是二氧化碳,其电子式是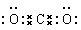 ;钠与氧形成的原子个数比为1∶1的化合物是过氧化钠,其电子式是
;钠与氧形成的原子个数比为1∶1的化合物是过氧化钠,其电子式是 。
。
(4)二氧化碳能与过氧化钠反应生成氧气和碳酸钠,反应的方程式为2CO2+2Na2O2=2Na2CO3+O2。
考点:考查位置、结构与性质应用的有关判断

 小学教材全测系列答案
小学教材全测系列答案下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
| A.②④⑤⑥ | B.①②④⑤ | C.①②⑤⑥ | D.③④⑤⑥ |
1907年2月2日,享誉世界的俄国化学家门捷列夫因心肌梗塞与世长辞,那一天距离他的73岁生日只有六天。门捷列夫在科学界的主要贡献是
| A.发现色盲现象 | B.发现元素周期律 |
| C.发明硝酸甘油炸药 | D.发现了放射性元素钋 |
下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| D.Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |
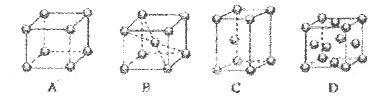
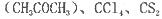 等互溶。
等互溶。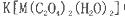 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。