题目内容
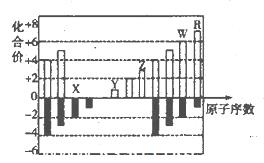
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。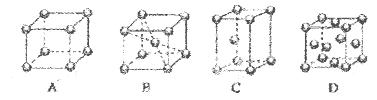
(1)M原子的外围电子排布式为_______________,在周期表中属于___________区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为____(填序号)。其空间利用率为____。
(3) MCl3?6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3,B、[M(H2O)5Cl]Cl2?H2O和C、[M(H2O)4Cl2]Cl?2H2O
为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.10molMCl3·6H2O 配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为___________(填A或B或C)。
(4)常温下为暗红色液体,熔点-96. 5℃,沸点117℃,能与丙酮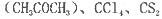 等互溶。
等互溶。
①固态MO2Cl2属于___________晶体;
②中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为______杂化和_____杂化。
(5)+3价M的配合物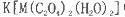 中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
中,配体是___________,与C2O42-互为等电子体的分子是(填化学式)_______________。
(1)3d54s1,d;(2)B;68%(3)B;(4)分子; sp、sp2;(5)C2O42-、H2O,N2O4。
解析试题分析:(1)M原子的最外层有空轨道,且有两个能级处于电子半充满状态,只能想到3d54s1,M为Cr,根据价电子排布式3d54s1,可以判断其所在分区,故答案为:3d54s1,d;
(2)堆积类型属于钾型,钾属于体心立方密堆积,根据图示可以看到B为体心立方密堆积,空间利用率为68%,故答案为:B;68%
(3)沉淀为AgCl,2.870 gAgCl的物质的量为0.02mol,所以n(Cl-)=0.02mol,说明1mol该物质外界含有2molCl-,通过观察可知,A中外界含有3molCl-,B中含有2molCl-,C中外界含1molCl-,只有B符合计算结果,故答案为B;
(4)①根据物理性质可知,该物质熔沸点较低,判断其晶体类型为分子晶体,故答案为分子;
②CS2结构类似于CO2,CO2为sp杂化,所以CS2的杂化类型也为sp1;丙酮羰基碳,形成三条Φ键,形成了三条杂化轨道,为sp2杂化,故答案为:sp、sp2;
(5)M提供空轨道,另外两种原子团提供孤对电子,观察络离子结构可知,C2O42-和H2O提供孤对电子,为配位体;C2O42-含有46个电子,且原子数为6,可以根据C、O原子相邻的元素来获得答案,与C相邻的N元素比C元素多一个电子,因此可以想到N2O4,故答案为:C2O42-、H2O,N2O4。
考点:考查电子排布式、分子空间构型、杂化类型的判断以及配合物等相关知识。

 优生乐园系列答案
优生乐园系列答案Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族。
(2)C的原子结构示意图是 ,
A元素与D元素形成化合物的电子式是 。
(3)F的元素符号是 。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是 。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。