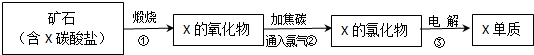
题目内容
18.下列是利用烃C3H6 合成有机高分子E和烃 C6H14的流程图.请回答以下问题:
(1)①一⑨中属于取代反应的有①②⑥,写出反应条件:反应②NaOH/H2O、加热.
(2)流程图中C6H14 的核磁共振氢谱只有两种峰,则 C6H14的结构简式为:(CH3)2CHCH(CH3)2写出E的结构简式:

(3)反应③和⑤的目的是保护碳碳双键.
(4)已知B( C3H5O2Cl)中无甲基,写出⑤反应的化学方式:CH2ClCH2COOH+2NaOH$→_{△}^{醇}$CH2=CHCOONa+NaCl+2H2O.
(5)D的同分异构体很多,符合F列条件的同分异构体有3种,其中核磁共振氢谱谱峰最少的结构简式为
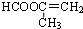 .
.①含碳碳双键 ②能水解 ③能发生银镜反应
(6)根据你所学知识和上图中相关信息,以乙醇为主要原料通过三步可能合成环己烷(无 机试剂任选),写出第一步化学反应的化学方程式(有机物质写结构简式)CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
分析 烃C3H6与HCl反应生成C3H7Cl,则烃C3H6为CH2=CHCH3,与HCl发生加成反应生成C3H7Cl,C3H7Cl在Na条件下生成C6H14,应属于取代反应;(2)中C6H14核磁共振谱只有两种峰,则C6H14的结构简式为(CH3)2CHCH(CH3)2,故C3H7Cl为(CH3)2CHCl;CH2=CHCH3与氯气在加热条件下生成C3H5Cl,应是发生取代反应,C3H5Cl通过反应②生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl;(4)已知B( C3H5O2Cl)中无甲基,
则A为CH2(Cl)CH2CH2OH,A被酸性高锰酸钾溶液氧化成B,则B通过反应⑤生成C3H3O2Na,则B为CH2ClCH2COOH、C3H3O2Na为CH2=CHCOONa;CH2=CHCOONa与甲醇发生酯化反应生成D,则D为:CH2=CHCOOCH3,D发生加聚反应生成E,则E为: ,据此进行解答.
,据此进行解答.
解答 解:烃C3H6与HCl反应生成C3H7Cl,则烃C3H6为CH2=CHCH3,与HCl发生加成反应生成C3H7Cl,C3H7Cl在Na条件下生成C6H14,应属于取代反应;(2)中C6H14核磁共振谱只有两种峰,则C6H14的结构简式为(CH3)2CHCH(CH3)2,故C3H7Cl为(CH3)2CHCl;CH2=CHCH3与氯气在加热条件下生成C3H5Cl,应是发生取代反应,C3H5Cl通过反应②生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl;(4)已知B( C3H5O2Cl)中无甲基,
则A为CH2(Cl)CH2CH2OH,A被酸性高锰酸钾溶液氧化成B,则B通过反应⑤生成C3H3O2Na,则B为CH2ClCH2COOH、C3H3O2Na为CH2=CHCOONa;CH2=CHCOONa与甲醇发生酯化反应生成D,则D为:CH2=CHCOOCH3,D发生加聚反应生成E,则E为: ,
,
(1)反应①为取代反应、反应②为取代反应、反应③为加成反应、反应④属于氧化反、反应⑤为消去反应、反应⑥属于酯化反应也属于取代反应、反应⑦为加聚反应、反应⑧为加成反应、反应⑨为酯化反应,故属于取代反应为:①②⑥;反应②为(CH3)2CHCl在NaOH/H2O、加热条件下发生消去反应生成CH2=CHCH2OH,
故答案为:①②⑥;NaOH/H2O、加热;
(2)C6H14核磁共振谱只有两种峰,则C6H14的结构简式为:(CH3)2CHCH(CH3)2,E的结构简式为: ,
,
故答案为:(CH3)2CHCH(CH3)2; ;
;
(3)根据合成流程可知,反应③和反应⑤分别是加成和消去反应,目的是避免酸性高锰酸钾氧化碳碳双键,从而保护了碳碳双键,
故答案为:保护碳碳双键;
(4)根据分析可知,B为CH2ClCH2COOH、C3H3O2Na为CH2=CHCOONa,反应⑤的方程式为:CH2ClCH2COOH+2NaOH$→_{△}^{醇}$CH2=CHCOONa+NaCl+2H2O,
故答案为:CH2ClCH2COOH+2NaOH$→_{△}^{醇}$CH2=CHCOONa+NaCl+2H2O;
(5)D(CH2=CHCOOCH3)的同分异构体很多,符合下列条件的同分异构体:①含碳碳双键 ②能水解,含有酯基,③能发生银镜反应,应含有甲酸形成的酯基,符合条件的同分异构体有:CH2=CHCH2OOCH、CH3CH=CHOOCH、CH2=C(CH3)OOCH,其中氢原子核磁共振谱谱峰最少的结构简式为: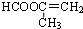 ,
,
故答案为:3;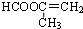 ;
;
(6)以乙醇为主要原料通过三步可能合成环己烷,首先在浓硫酸、加热170℃条件下发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,根据转化中反应⑦可知,1,2-二溴乙烷与Na发生反应生成环己烷与NaBr,故:第一步反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题考查有机物的推断,题目难度较大,注意根据有机物分子式与反应条件推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生的分析、理解能力及逻辑推理能力.

| 选项 | 操作 | 现象 | 结论 |
| A | Al2(SO4)3溶液中滴加过量Ba(OH)2 | 生成白色沉淀物 | Al(OH)3不溶于Ba(OH)2 |
| B | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2具有氧化性 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中可能含有SO42- |
| D | 向CuCl2和MgCl2混合溶液中加入过量的NaOH溶液 | 产生蓝色沉淀 | NaOH不和MgCl2反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 1molCl2与足量Fe反应转移电子数一定为3NA | |
| C. | 1mol氨基(-NH2)中含电子数为10nA | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 氨气:K+、Na+、AlO2-、CO32- | D. | 乙烯:H+、K+、MnO4-、SO42- |
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
| A. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2═2I2+2Fe3++6C1- | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| A. | N2→NH3 | B. | NH3→NH4Cl | C. | N2→NO | D. | NO→NO2 |