题目内容
13.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
分析 元素B的原子最外层电子数是其电子层数的2倍,B为2个电子层时,B为C,为3个电子层时为S,A、E的单质在常温下呈气态,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,则D为Al,结合原子序数依次增大,则E为Cl,C为Na,B只能为C,A为H,然后结合元素及其化合物的性质来解答.
解答 解:元素B的原子最外层电子数是其电子层数的2倍,B为2个电子层时,B为C,为3个电子层时为S,A、E的单质在常温下呈气态,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,则D为Al,结合原子序数依次增大,则E为Cl,C为Na,B只能为C,A为H,
A.元素A、B组成的化合物常温下可能为气态、液体、固体,如烷烃中C原子数少于4个为气体,随碳原子个数增多,为液体、固体,故A错误;
B.对于Na、Al、Cl2的制备,在工业上都采用电解的方法,故B正确;
C.化合物AE为HCl,含共价键,CE为NaCl,含离子键,融化状态下AE不能被电解,故C错误;
D.氢氧化铝是两性氢氧化物与高氯酸反应生成盐和水,故D错误;
故选B.
点评 本题考查位置、结构、性质的关系及应用,元素的推断是解答的关键,注意把握元素的性质及单质、化合物的性质即可解答,题目难度中等.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
3.下列有关实验的叙述错误的是( )
| A. | 实验室中可以用生石灰与浓氨水混合的方法制取少量氨气 | |
| B. | 酸碱滴定实验中,滴定管装液前应用待装溶液润洗,锥形瓶不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的3/4 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
4.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
1.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. | 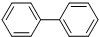 、 、 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
8.25℃时,下列说法一定正确的是( )
| A. | 在pH=4的溶液中,水所电离出的总的c(OH-)是10-10 mol•L-1 | |
| B. | 将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7 | |
| C. | 将pH=4的盐酸和pH=4的醋酸分别与足量NaHCO3反应,后者产生CO2多 | |
| D. | 将pH=4醋酸和pH=10的氢氧化钠任意比例混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
17.食用下列物质不会引起中毒的是( )
| A. | 用三聚氰胺配制的奶粉 | B. | 加有大量亚硝酸钠(NaNO2)的火腿 | ||
| C. | 用碳酸钡做x射线透视的“钡餐” | D. | 加碘盐(含碘酸钾的食盐) |


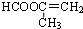 .
.