题目内容
17. 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
(1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②S(g)+O2(g)═SO2(g)△H2=-296.0kJ•mol-1
试计算2CO(g)+SO2(g)?S(g)+2CO2(g)△H=-270kJ•mol-1.
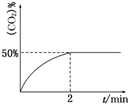
(2)在容积为2L的密闭容器中,充入4mol CO和2mol SO2,在一定条件下发生反应:2CO(g)+SO2(g)?S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示:
①0~2min内的平均反应速率v(CO)=0.75mol•L-1•min-1.
②2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是D
A.选用更高效的催化剂 B.升高温度
C.及时分离出二氧化碳 D.增加SO2的浓度
③相同温度下,若开始加入CO和SO2的物质的量是原来的2倍,则B是原来的2倍.
A.达到平衡的时间 B.CO的平衡浓度
C.平衡常数 D.平衡时SO2的转化率.
分析 (1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g),根据盖斯定律计算反应的焓变;
(2)根据图象,反应平衡时二氧化碳的体积分数为50%,则设0-2min内的消耗SO2为xmol,
根据反应的化学反应方程式:2CO(g)+SO2(g)?S(g)+2CO2(g),
开始:4 2 0 0
转化:2x x x 2x
平衡:4-2x 2-x x 2x
则根据平衡时二氧化碳的体积分数为50%,有$\frac{2x}{6}$=50%,则x=1.5mol,
①根据反应速率V=$\frac{△c}{△t}$进行计算;
②a.选用更高效的催化剂,反应速率增大,但平衡不移动;
b.升高温度,反应速率增大,但平衡向逆反应移动;
c.及时分离出二氧化碳,平衡向正反应移动,但反应速率减小;
d.增加SO2的浓度,反应速率增大,平衡向正反应移动
③A.反应物物质的量增加,浓度增大,反应速率加快;
B、物质的量加倍,体积不变,各组分的浓度会加倍;
C、温度不变,平衡常数不变;
D、物质的量加倍,增大压强,平衡正向移动,增加反应物的转化率.
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1,
故答案为:-270 kJ•mol-1;
(2)①根据图象,反应平衡时二氧化碳的体积分数为50%,则设0-2min内的消耗SO2为xmol,
根据反应的化学反应方程式:2CO(g)+SO2(g)?S(g)+2CO2(g),
开始:4 2 0 0
转化:2x x x 2x
平衡:4-2x 2-x x 2x
则根据平衡时二氧化碳的体积分数为50%,有$\frac{2x}{6}$=50%,则x=1.5mol;
①0-2min内的平均反应速率v(CO)=$\frac{\frac{3}{2}}{2}$ mol•L-1•min-1=0.75 mol•L-1•min-1,故答案为:0.75 mol•L-1•min-1;
②A.选用更高效的催化剂,反应速率增大,但平衡不移动,故错误;
B.升高温度,反应速率增大,但平衡向逆反应移动,故错误;
C.及时分离出二氧化碳,平衡向正反应移动,但反应速率减小,故错误;
D.增加SO2的浓度,反应速率增大,平衡向正反应移动,故正确;
故选D;
③A、反应物物质的量增加,浓度增大,反应速率加快,达到平衡时间比原来缩短,故错误;
B、压强增大平衡正向移动,CO的平衡浓度为原来的2倍,故正确;
C、平衡常数只受温度影响,温度不变,平衡常数不变,故错误;
d.增大压强平衡正向移动,平衡时SO2的转化率增加,小于原来的2倍,故错误.
故选B.
点评 本题考查综合考查化学反应与能量变化、化学平衡的计算及其平衡移动的判断,注意掌握三段式法进行计算的方法,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力,注意键能与反应热的计算关系,题目难度中.

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
| A. | 在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量等于196.64kJ | |
| B. | 在容器中当有2mol SO2和1mol O2发生反应时,放出的热量等于196.64kJ | |
| C. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为-393.28kJ/mol | |
| D. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为98.32kJ/mol |
| A. | 胶体区别于其它分散系的本质特性是丁达尔效应 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 胶体能产生丁达尔效应的原因是胶粒使光线发生了折射 |
| A. | 氢氧化钡溶液与硫酸的反应Ba2++OH-+H++SO42-═Ba SO4↓+H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-═CO32-+H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |