题目内容
11.Ⅰ.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.请回答下列问题.(1)乙烯的结构简式为CH2=CH2 .
(2)下列物质中,不可以通过乙烯加成反应得到的是B(填序号).
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
Ⅱ.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题:
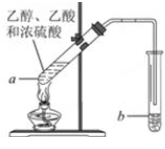
(3)乙酸中官能团的名称是羧基.
(4)试管a中发生反应的化学方程式为CH3COOH+C2H5OH $?_{加热}^{浓硫酸}$ CH3COOC2H5+H2O;反应类型是酯化反应.
(5)反应开始前,试管b中盛放的溶液是饱和碳酸钠溶液.
分析 I、(1)乙烯是含有碳碳双键的最简单的烯烃;
(2)乙烯加成反应的特征是原子或原子团加在双键碳原子上,双键变为单键;
II、(3)羧酸的官能团为羧基;
(4)乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,属于酯化反应;
(5)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层.
解答 解:I、(1)乙烯中含碳和碳之间以共价双键结合,结构简式为:H2C=CH2,故答案为:H2C=CH2;
(2)乙烯和氢气加成生成乙烷,和水加成生成乙醇,和溴化氢发生加成生成溴乙烷,CH3CHCl2无法通过加成反应制得,故答案为:B;
II、(3)羧酸的官能团是-COOH,名称为羧基,故答案为:羧基;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为CH3COOH+C2H5OH $?_{加热}^{浓硫酸}$ CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH $?_{加热}^{浓硫酸}$ CH3COOC2H5+H2O;酯化反应;
(5)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层.故答案为:饱和碳酸钠溶液.
点评 本题主要考查的是乙烯的性质以及乙酸乙酯的制备,注意实验的基本操作、饱和碳酸钠溶液的作用以及酯化反应的机理.

练习册系列答案
相关题目
1.如表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式n CH2=CH2$\stackrel{一定条件}{→}$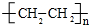 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式 .
.
(4)C与E反应能生成相对分子质量为100的酯,该反应类型为取代反应;其化学方程式为CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
| A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C ③比例模型为: 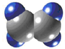 |
| B | ①由C、H两种元素组成; ②球棍模型为: 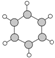 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为:  |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式n CH2=CH2$\stackrel{一定条件}{→}$
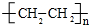 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式
 .
.(4)C与E反应能生成相对分子质量为100的酯,该反应类型为取代反应;其化学方程式为CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
19.某元素X的气态氢化物化学式为XH3,则X的最高价氧化物的水化物及相应的酸性氧化物化学式均正确的是( )
| A. | HXO3 XO2 | B. | HXO2 X2O3 | C. | H3XO3 X2O3 | D. | H3XO4 X2O5 |
6.下列化学用语正确的是( )
| A. | Cl?的结构示意图: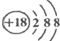 | B. | 氯化氢的电子式为: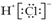 | ||
| C. | 甲烷的比例模型: | D. | 乙醛的结构简式:C2H4O |
16.在一定温度下,不能做为反应A2(g)+B2(g)?2AB(g)达到平衡的判断标志是( )
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
20.下列关于有机物存在的叙述中,错误的是( )
| A. | 工业酒精中含有乙醇和甲醇 | B. | 在煤炭和石油中,苯的含量都较高 | ||
| C. | 许多水果中含有酯类化合物 | D. | 天然油脂中含有高级脂肪酸甘油酯 |
1.下述实验不能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将少量氯水加入NaBr溶液中,并加适量CCl4振荡、静置 | 比较氯与溴单质的氧化性强弱 |
| B | 分别向2去试管中加入3ml,5%的H2O2溶液,一支放入5℃左右的冷水中,另一支放入40℃左右的热水中,观察 | 比较温度对化学反应速率的影响 |
| C | 向溶液中滴加盐酸酸化的氯化钡溶液 | 检验某溶液中是否一定含SO42- |
| D | 将实验室制得的CO2依次通过饱和NaHCO3溶液和浓硫酸 | 除去CO2中的HCl和H2O蒸气 |
| A. | A | B. | B | C. | C | D. | D |
