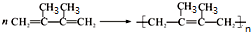题目内容
8.下列物质中,既含离子键、又含非极性共价键的是( )| A. | NaOH | B. | Na2O2 | C. | NH4Cl | D. | Na2O |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,部分碱、大多数盐和金属氧化物、铵盐中含有离子键,据此分析解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A错误;
B.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故B正确;
C.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在极性键,故C错误;
D.氧化钠中钠离子和氧离子之间存在离子键,故D错误;
故选B.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确二者概念区别是解本题关键,注意过氧化钠电子式的书写,为易错点.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
19.某元素X的气态氢化物化学式为XH3,则X的最高价氧化物的水化物及相应的酸性氧化物化学式均正确的是( )
| A. | HXO3 XO2 | B. | HXO2 X2O3 | C. | H3XO3 X2O3 | D. | H3XO4 X2O5 |
16.在一定温度下,不能做为反应A2(g)+B2(g)?2AB(g)达到平衡的判断标志是( )
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
20.下列关于有机物存在的叙述中,错误的是( )
| A. | 工业酒精中含有乙醇和甲醇 | B. | 在煤炭和石油中,苯的含量都较高 | ||
| C. | 许多水果中含有酯类化合物 | D. | 天然油脂中含有高级脂肪酸甘油酯 |
15.下列变化中涉及化学变化的是( )
(1)爆竹燃放 (2)碘的升华
(3)金属钝化 (4)铝热反应
(5)干冰汽化(6)加热氯化铵
(7)甘油加水作护肤剂 (8)明矾净水
(9)蜂蚁螫咬后涂稀氨水可以减痛
(10)医用酒精可用于皮肤消毒
(11)烹鱼时加入少量的料酒和食醋可减少腥味
(12)橡胶老化 (13)用四氯化碳可擦去圆珠笔油渍
(14)蛋白质的盐析.
(1)爆竹燃放 (2)碘的升华
(3)金属钝化 (4)铝热反应
(5)干冰汽化(6)加热氯化铵
(7)甘油加水作护肤剂 (8)明矾净水
(9)蜂蚁螫咬后涂稀氨水可以减痛
(10)医用酒精可用于皮肤消毒
(11)烹鱼时加入少量的料酒和食醋可减少腥味
(12)橡胶老化 (13)用四氯化碳可擦去圆珠笔油渍
(14)蛋白质的盐析.
| A. | (1)(3)(4)(5)(7)(12)(13) | B. | (2)(4)(5)(7)(12)(13)(14) | ||
| C. | (2)(5)(7)(13)(14) | D. | 以上选项均不正确 |

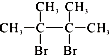 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答: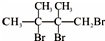 .
.