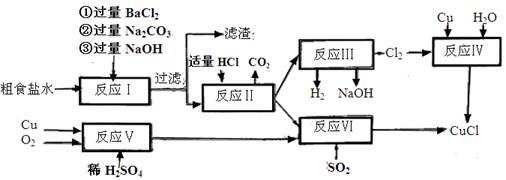
题目内容
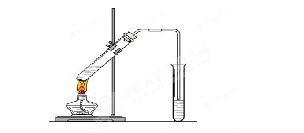
(15分)氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气.根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢.某课外小组在实验室进行了探索性实验,设计了如图装置:
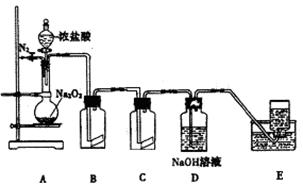
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
⑴写出KClO3氧化浓盐酸制取Cl2的离子方程式
⑵装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
⑶装置D的作用是
⑷写出生成O2的可能的反应方程式
⑸实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室 (填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是

操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
⑴写出KClO3氧化浓盐酸制取Cl2的离子方程式
⑵装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
⑶装置D的作用是
⑷写出生成O2的可能的反应方程式
⑸实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室 (填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是
(1)ClO3-+5Cl-+6H+=3Cl2↑+3H2O(2分)
(2)Cl2(2分) 4H+ + 4I-+ O2 ="==" 2I2 + 2H2O(2分,写2H2O + 4I-+ O2 ="==" 2I2+4OH-得1分)
(3)吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气(2分)
(4)2Na2O2 + 2H2O="=4NaOH+" O2(2分)
(5) Na2O2 + 4HCl ="=" Cl2 + 2NaCl + 2H2O(2分)否(1分)
①Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中(1分)(答出任何一点即可)
②实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢(1分)(答出任何一点即可,其他合理答案均可)
(2)Cl2(2分) 4H+ + 4I-+ O2 ="==" 2I2 + 2H2O(2分,写2H2O + 4I-+ O2 ="==" 2I2+4OH-得1分)
(3)吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气(2分)
(4)2Na2O2 + 2H2O="=4NaOH+" O2(2分)
(5) Na2O2 + 4HCl ="=" Cl2 + 2NaCl + 2H2O(2分)否(1分)
①Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中(1分)(答出任何一点即可)
②实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢(1分)(答出任何一点即可,其他合理答案均可)
(1)氯酸钾氧化浓盐酸的氧化产物和还原产物都是氯气,方程式为
ClO3-+5Cl-+6H+=3Cl2↑+3H2O。
(2)装置B中湿润的红色布条褪色,说明有次氯酸产生,所以A中有氯气生成。由于过氧化钠和水反应也生成氧气,二氧化也能氧化碘化钾,生成单质碘,所以不能仅通过试纸变蓝证明上述结论。氯气溶于水显酸性,所以方程式为4H+ + 4I-+ O2 ="==" 2I2 + 2H2O。
(3)氯气有毒,需要尾气处理。另一方面也保证最后得到的是纯净氧气,即作用是吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气。
(4)过氧化钠溶于水即生成氧气,方程式为2Na2O2 + 2H2O="=4NaOH+" O2。
(5)过氧化钠氧化氯化氢的生成物是氯气,还原产物是水,所以方程式为Na2O2 + 4HCl ="=" Cl2 + 2NaCl + 2H2O。由于在生成氯气的同时,还会生成氧气,所以得不到纯净的氯气。
ClO3-+5Cl-+6H+=3Cl2↑+3H2O。
(2)装置B中湿润的红色布条褪色,说明有次氯酸产生,所以A中有氯气生成。由于过氧化钠和水反应也生成氧气,二氧化也能氧化碘化钾,生成单质碘,所以不能仅通过试纸变蓝证明上述结论。氯气溶于水显酸性,所以方程式为4H+ + 4I-+ O2 ="==" 2I2 + 2H2O。
(3)氯气有毒,需要尾气处理。另一方面也保证最后得到的是纯净氧气,即作用是吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气。
(4)过氧化钠溶于水即生成氧气,方程式为2Na2O2 + 2H2O="=4NaOH+" O2。
(5)过氧化钠氧化氯化氢的生成物是氯气,还原产物是水,所以方程式为Na2O2 + 4HCl ="=" Cl2 + 2NaCl + 2H2O。由于在生成氯气的同时,还会生成氧气,所以得不到纯净的氯气。

练习册系列答案
相关题目
 。
。

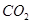 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程: