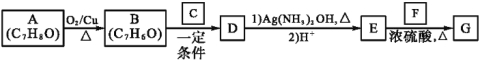
题目内容
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
【答案】
(1)①温度升高,反应速率加快,温度升高,有利于平衡反应正向进行;②不能,该反应是焓增、熵减的反应,任何温度下均不能自发进行;
(2)Cl2+H2O![]() HCl + HclO,增大;
HCl + HclO,增大;
(3)正反应,加入少许铁粉或加入少许碘(其他合理设计即可)
(4)①4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,31.9
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,31.9
【解析】
试题分析:(1)①气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,反应速率越快,单位时间内NO排放量越大;该反应吸热,升高温度平衡正向移动,温度越高,单位时间内NO排放量越大。
2NO(g) △H >0。汽车启动后,气缸内温度越高,反应速率越快,单位时间内NO排放量越大;该反应吸热,升高温度平衡正向移动,温度越高,单位时间内NO排放量越大。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,ΔS<0, ![]() ,任何温度下均不能自发进行。
,任何温度下均不能自发进行。
(2)Cl2与水反应是可逆反应,反应的化学方程式为Cl2+H2O![]() HCl + HClO,在上述平衡体系中加入少量NaOH固体,消耗盐酸、次氯酸,Cl2+H2O
HCl + HClO,在上述平衡体系中加入少量NaOH固体,消耗盐酸、次氯酸,Cl2+H2O![]() HCl + HclO平衡正向移动,溶液中Cl—浓度 增大。
HCl + HclO平衡正向移动,溶液中Cl—浓度 增大。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,溶液中碘的浓度减小,述平衡向正反应方向移动。加入少许铁粉或加入少许碘可使化学平衡逆向移动。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,溶液中碘的浓度减小,述平衡向正反应方向移动。加入少许铁粉或加入少许碘可使化学平衡逆向移动。
(4)反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
①反应A的热化学方程式4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。
②设H—Cl键的键能为x,H—O键的键能为y,反应物的总键能-生成物的总键能=焓变,即4x+498-2×243-4y=-115.6,y-x=31.9kJ。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案