题目内容
【题目】![]() 和
和![]() 是两种主要的温室气体,以
是两种主要的温室气体,以![]() 和
和![]() 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上![]() 催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
反应Ⅰ:![]() ;
;![]()
反应Ⅱ:![]() ;
;![]()
![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式是___________________。
的热化学方程式是___________________。
(2)将1 mol ![]() 和1 mol
和1 mol ![]() 加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率
加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率![]() ,p为分压(分压=总压×物质的量分数),若该条件下
,p为分压(分压=总压×物质的量分数),若该条件下![]() ,当
,当![]() 分解20%时,
分解20%时,![]() __________kPas-1。
__________kPas-1。
(3)将![]() 和
和![]() 在一定条件下反应可制得合成气,在1 L密闭容器中通入
在一定条件下反应可制得合成气,在1 L密闭容器中通入![]() 与
与![]() ,使其物质的量浓度均为
,使其物质的量浓度均为![]() ,在一定条件下发生反应:
,在一定条件下发生反应:,测得CH4的平衡转化率与温度及压强的关系如下图所示:
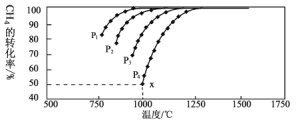
①压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的关系为_________。
由小到大的关系为_________。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作![]() ),如果
),如果![]() ,求x点的平衡常数
,求x点的平衡常数![]() ________________(用平衡分压代替平衡浓度计算)。
________________(用平衡分压代替平衡浓度计算)。
③下列措施中能使平衡正向移动的是___________(填字母)。
a.升高温度
b.增大压强
c.保持温度、压强不变,充入He
d.恒温、恒容,再充入1 mol ![]() 和1 mol
和1 mol ![]()
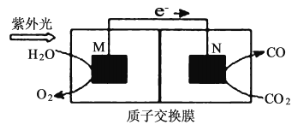
(4)科学家还研究了其他转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量
转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量![]() __________g。
__________g。
【答案】![]()
![]() 0.5
0.5 ![]()
![]() 或
或![]() acd 负 不变 18
acd 负 不变 18
【解析】
(1)反应Ⅰ:![]()
![]()
反应Ⅱ:![]() ;
;![]()
利用盖斯定律,将反应Ⅰ+反应Ⅱ,即可得出热化学方程式为![]()
![]() 。答案为:
。答案为:![]()
![]() ;
;
(2) 当CH4分解20%时,建立如下三段式:

![]() =4.5×10-4kPa-1s-1×(
=4.5×10-4kPa-1s-1×(![]() ×100kPa)×(
×100kPa)×(![]() ×100kPa)=0.5 kPas-1。答案为:0.5;
×100kPa)=0.5 kPas-1。答案为:0.5;
(3)①从方程式看,加压平衡逆向移动,CH4的转化率减小,由此得出压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的关系为
由小到大的关系为![]() 。答案为:
。答案为:![]() ;
;
②在x点,CH4的转化率为50%,建立三段式:

x点的平衡常数Kp= =
=![]() 或
或![]() 。答案为:
。答案为:![]() 或
或![]() ;
;
③a.从图象看,升高温度,CH4的转化率增大,则正反应为吸热反应,升高温度平衡右移,a符合题意;
b.反应物气体分子数小于生成物气体分子数,增大压强,平衡逆向移动,b不合题意;
c.保持温度、压强不变,充入He,则容器体积增大,平衡正向移动,c符合题意;
d.恒温、恒容,再充入1 mol ![]() 和1 mol
和1 mol ![]() ,则增大反应物浓度,平衡正向移动,d符合题意;
,则增大反应物浓度,平衡正向移动,d符合题意;
故选acd。答案为:acd;
(4)该装置工作时,M极由H2O失电子转化为O2,则其为负极;M极:2H2O-4e-=O2+4H+,N极:2CO2+4e-+4H+=2CO+2H2O,导线中通过2 mol电子,M极生成2molH+,同时有2molH+转移入正极,所以M极c(H+)不变,电解质溶液的pH不变;导线中通过2 mol电子,N极生成1molH2O,电解质溶液变化的质量![]() =1mol×18g/mol=18g。答案为:负;不变;18。
=1mol×18g/mol=18g。答案为:负;不变;18。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】根据实验操作及现象所得出的解释或结论不正确的是( )
选项 | 实验操作及现象 | 解释或结论 |
A. | 向某溶液中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生 | 该溶液中一定含有SO |
B. | 向某溶液中加入浓NaOH溶液,加热,产生 能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
C. | 向某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3或KHCO3 |
D. | 酸性硝酸铁溶液中加入几滴碘化钾淀粉溶液,出现蓝色 | 铁离子具有较强氧化性,将I-氧化生成I2 |
A.AB.BC.CD.D
【题目】三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图所示:

已知:
Ⅰ.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
完全沉淀时的pH | 3.7 | 9.0 | 9.2 |
回答下列问题:
(1)“酸浸”含钴废料的温度不宜过高,原因是_____________。
(2) “酸浸”时发生的主要反应是___________________(写离子方程式)。
(3)某萃取剂对金属离子的萃取率与溶液pH的关系如图所示:
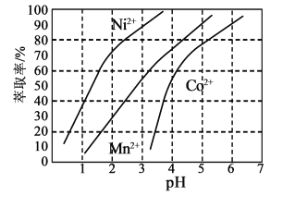
使用该萃取剂时应控制的pH约为____________,理由是_____________。
(4)写出高温煅烧时发生的化学反应方程式___________。
(5)操作1得到的副产品是__________(填名称);
已知该物质的溶液加热到100℃时会变质,该物质的溶解度见下表:
湿度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
溶解度 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
操作1是________(填字母)。
a.蒸发结晶 b.降温结晶 c.减压蒸发结晶
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_________________。