题目内容
【题目】根据实验操作及现象所得出的解释或结论不正确的是( )
选项 | 实验操作及现象 | 解释或结论 |
A. | 向某溶液中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生 | 该溶液中一定含有SO |
B. | 向某溶液中加入浓NaOH溶液,加热,产生 能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
C. | 向某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3或KHCO3 |
D. | 酸性硝酸铁溶液中加入几滴碘化钾淀粉溶液,出现蓝色 | 铁离子具有较强氧化性,将I-氧化生成I2 |
A.AB.BC.CD.D
【答案】D
【解析】
A.向溶液中加入足量稀盐酸,无明显现象说明溶液中不含亚硫酸根、银离子、碳酸根等其他离子,再向溶液中加入BaCl2溶液,有白色沉淀产生,说明原溶液中含有硫酸根,A正确;
B.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,该气体为氨气呈碱性,说明原溶液中含有铵根,B正确;
C.向某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色无味气体,说明该无色无味气体为二氧化碳,则原溶液中含有碳酸根或碳酸氢根,C正确;
D.酸性硝酸铁溶液中含有硝酸,硝酸具有强氧化性,可以氧化碘离子,不能说明铁离子氧化碘离子,D错误;
故选D。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
【题目】某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是( )
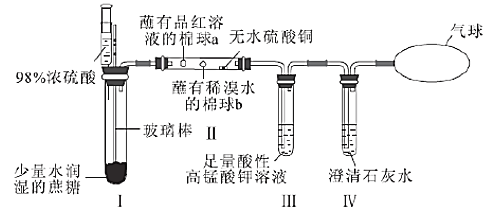
选项 | 现象 | 结论 |
A. | Ⅰ中注入浓硫酸后,可观察到试管中白色固体变为黑色 | 体现了浓硫酸的吸水性 |
B. | Ⅱ中观察到棉球a、b都褪色 | 均体现了SO2的漂白性 |
C. | Ⅱ中无水硫酸铜变蓝 | 说明反应产物中有H2O |
D. | Ⅲ中溶液颜色变浅,Ⅳ中澄清石灰水变浑浊 | 说明有CO2产生 |
A.AB.BC.CD.D