题目内容
【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
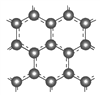
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
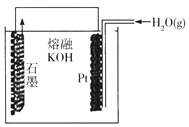
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。
【答案】 0.08 mol/(L·min) abd 5:3 a C-2e- +2OH-=CO↑+H2O 不成立。因为根据反应C(s)+H2O(g) ![]() CO(g) +H2(g),物质的断键和成键的能量变化是:1.5×475.7 kJ +2×463 kJ -1072 kJ - 436 kJ=+131.5 kJ>0,说明是吸热反应,不能将化学能转化为电能
CO(g) +H2(g),物质的断键和成键的能量变化是:1.5×475.7 kJ +2×463 kJ -1072 kJ - 436 kJ=+131.5 kJ>0,说明是吸热反应,不能将化学能转化为电能
【解析】试题分析:本题考查化学反应速率的计算,化学平衡的标志,化学平衡的计算和极限法,电极反应式的书写,反应热的计算。
(1)①C的转化率为20%,转化C的物质的量为4mol![]() 20%=0.8mol,则转化H2O(g)的物质的量为0.8mol,υ[H2O(g)]=0.8mol
20%=0.8mol,则转化H2O(g)的物质的量为0.8mol,υ[H2O(g)]=0.8mol![]() 2L
2L![]() 5min=0.08mol/(L·min)。
5min=0.08mol/(L·min)。
② a项,反应生成的CO和H2的物质的量之比为1:1,反应生成的CO和H2的平均相对分子质量为15(28![]() 1/2+2
1/2+2![]() 1/2=15),建立平衡的过程中气体的平均相对分子质量减小,平衡时气体的平均相对分子质量不变,气体的平均相对分子质量不变表明反应达到平衡状态;b项,建立平衡过程中气体的质量增大,容器体积不变,气体的密度增大,平衡时气体的质量不变,气体的密度不变,气体的密度不变表明反应达到平衡状态;c项,平衡时各物质的浓度不再变化,不一定等于化学计量数之比,H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1不能说明反应一定达到平衡状态;d项,该反应的正反应为气体分子数增大的反应,建立平衡过程中气体物质的量增大,平衡时气体物质的量不变,气体的总物质的量不变说明反应达到平衡状态;能说明反应达到平衡的标志是abd。
1/2=15),建立平衡的过程中气体的平均相对分子质量减小,平衡时气体的平均相对分子质量不变,气体的平均相对分子质量不变表明反应达到平衡状态;b项,建立平衡过程中气体的质量增大,容器体积不变,气体的密度增大,平衡时气体的质量不变,气体的密度不变,气体的密度不变表明反应达到平衡状态;c项,平衡时各物质的浓度不再变化,不一定等于化学计量数之比,H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1不能说明反应一定达到平衡状态;d项,该反应的正反应为气体分子数增大的反应,建立平衡过程中气体物质的量增大,平衡时气体物质的量不变,气体的总物质的量不变说明反应达到平衡状态;能说明反应达到平衡的标志是abd。
(2)①设反应开始前H2O(g)、H2(g)物质的量依次为xmol、ymol,转化H2O(g)物质的量为amol,用三段式
C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
n(起始)(mol) x 0 y
n(转化)(mol) a a a
n(某时刻)(mol) x-a a y+a
左室中气体的平均相对分子质量一直保持不变, ![]() =
=![]() ,解得x:y=5:3,反应开始前H2O(g)、H2(g)物质的量之比为5:3。
,解得x:y=5:3,反应开始前H2O(g)、H2(g)物质的量之比为5:3。
②设反应开始前H2O(g)、H2(g)物质的量依次为xmol、ymol,起始到平衡转化H2O(g)物质的量为bmol,用三段式
C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
n(起始)(mol) x 0 y
n(转化)(mol) b b b
n(平衡)(mol) x-b b y+b
根据同温同压下气体体积之比等于气体物质的量之比,反应前(x+y):n(N2)=1:2,x的最大值为n(N2)/2;反应达到平衡时,左室气体物质的量为x+y+b,由于是可逆反应则0![]() b
b![]() x,左室反应达平衡时气体物质的量x+y
x,左室反应达平衡时气体物质的量x+y![]() x+y+b
x+y+b![]() x+y+x,左室气体物质的量n(N2)/2
x+y+x,左室气体物质的量n(N2)/2![]() x+y+b
x+y+b![]() n(N2),右室N2物质的量不变,根据同温同压下气体体积之比等于气体物质的量之比,左室达平衡时隔板所处位置在1~1.5之间,答案选a。
n(N2),右室N2物质的量不变,根据同温同压下气体体积之比等于气体物质的量之比,左室达平衡时隔板所处位置在1~1.5之间,答案选a。
(3)①反应中C元素的化合价由0价升至CO中的+2价,石墨电极发生失电子的氧化反应,电极反应式为C(s)-2e-+2OH-=CO↑+H2O。
②根据石墨的结构,1mol石墨中含碳碳键1.5mol,反应C(s)+H2O(g) ![]() CO(g)+H2(g)的ΔH=反应物的键能总和-生成物的键能总和=1.5E(碳碳键)+2E(H-O)-E(C
CO(g)+H2(g)的ΔH=反应物的键能总和-生成物的键能总和=1.5E(碳碳键)+2E(H-O)-E(C![]() O)-E(H-H)=1.5
O)-E(H-H)=1.5![]() 475.7kJ/mol+2
475.7kJ/mol+2![]() 463kJ/mol-1072kJ/mol-436kJ/mol=+131.55kJ/mol,该反应为吸热反应,不能通过原电池将化学能转化成电能,构想不成立。
463kJ/mol-1072kJ/mol-436kJ/mol=+131.55kJ/mol,该反应为吸热反应,不能通过原电池将化学能转化成电能,构想不成立。