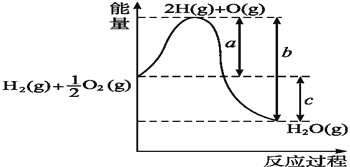
题目内容
【题目】N、P、As的化合物在研究和生产中有许多重要用途。
(1)基态As原子的核外电子排布式为_________。
(2)N的第一电离能比O大,原因是______________。
(3)NH4+中H-N-H的键角比NH3中H-N-H 的键角_______(填“大”或“小”),原因是____________。
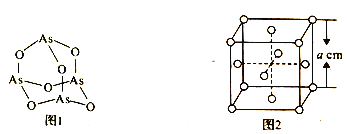
(4)K3AsO4中含有的化学键类型包括________;AsO43- 的空间构型为______。As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5 是_______晶体。
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2 (小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数的数值为NA,则该晶胞中含有P 原子的个数为______,该晶体的密度为_________(用含NA、a 的代数式表示) g.cm-3。
【答案】 1s22s22p63s23p63d104s24p3{或[Ar]3d104s24p3} N的2P轨道是半充满状态,比较稳定,所以第一电离能比氧的大 大 NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力 离子键、共价键 正四面体 sp3 离子 16 ![]()
【解析】(1)砷位于元素周期表的第四周期第VA族,外围电子排布为4s24p3,把前面的核外电子补齐后得砷基态电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;(2). N的2P轨道是半充满状态,比较稳定,所以第一电离能比氧的大;(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H键角比NH3中H-N-H键角大;(2)K3AsO4属于离子化合物,酸根离子中含有共价键,故K3AsO4中含有的化学键类型包括离子键、共价键;AsO43-中As原子孤电子对数=![]() =0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,是sp3杂化;(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成,属于离子晶体;(6)根据均摊法可知,晶胞中P4分子数目为8×
=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,是sp3杂化;(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成,属于离子晶体;(6)根据均摊法可知,晶胞中P4分子数目为8×![]() +6×
+6×![]() =4,则晶胞中P原子数目为4×4=16,晶胞质量为
=4,则晶胞中P原子数目为4×4=16,晶胞质量为![]() g,晶胞体积为(acm)3,则晶胞密度为
g,晶胞体积为(acm)3,则晶胞密度为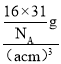 =
=![]() g.cm-3。
g.cm-3。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
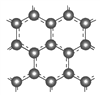
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
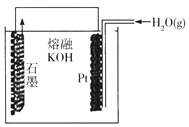
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
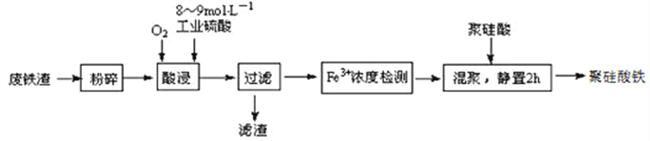
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
【题目】严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。