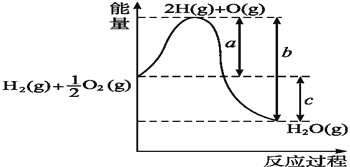
题目内容
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等) 和黄铁矿粉(主要成分为FeS2) 制备铁黄的流程如下。
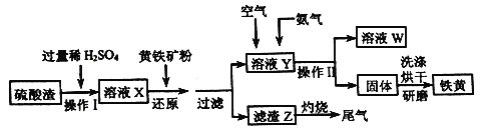
回答下列问题:
(1)操作I中为了提高硫酸渣的溶解速率,可采取的措施有_________(答两条即可)。
(2)溶液X中含有的金属离子有Fe3+和_____;溶液X中加入黄铁矿粉后,先发生反应FeS2+H2SO4( 稀)=FeSO4+ H2S↑+S↓,H2S 再将Fe3+还原,其离子方程式为_________。
(3)在溶液Y 中通入空气的目的是______________,再通入NH3后可观察到的现象是__________,若通入NH3后溶液的pH 过高,会影响产品纯度,原因是_________。
(4)操作II中除用到玻璃棒外,还需要的玻璃仪器是________。
(5)若将滤渣Z灼烧产生的尾气通入溶液X 中,充分反应后溶液的pH____(填“增大”、“减小”或“不变”)。
(6)为了测定所制备铁黄Fe2O3xH2O中x的值,用分析天平准确称量m1g样品置于坩埚中加热、冷却后称量;经过重复操作,当达到恒重时,残留固体质量为m2g,则x =______。
【答案】 适当增大稀硫酸浓度、提高反应温度、减小硫酸渣粒径 Mg2+、Ca2+ 2Fe3++H2S=2Fe2++S↓+2H+ 将Fe2+氧化成Fe3+ 产生红褐色沉淀 Mg2+转化为Mg(OH)2沉淀,降低产品纯度 烧杯、漏斗 减小 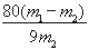
【解析】硫酸渣中含Fe2O3、CaO、MgO等,用稀硫酸溶解,过滤除去不溶物,再加FeS2发生反应FeS2+H2SO4(稀)═FeSO4+H2S↑+S↓,H2S可以将Fe3+还原为Fe2+,过滤分离,滤渣含有S、FeS2等,滤液中含有Fe2+,通入空气将Fe2+氧化成Fe3+,氨气反应得到Fe(OH)3,过滤分离,烘干得到铁黄,溶液W中含有硫酸铵等。
(1)适当增加稀硫酸浓度、提高反应温度、粉碎硫酸渣增大接触面积等,都可提高硫酸渣的溶解速度,故答案为:适当增加稀硫酸浓度、提高反应温度、粉碎硫酸渣增大接触面积;
(2)硫酸渣中含Fe2O3、CaO、MgO都能被硫酸溶解,因此溶液X中含有的金属离子有Fe3+和Mg2+、Ca2+;H2S可以将Fe3+还原为Fe2+,同时生成S,反应离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,故答案为:Mg2+、Ca2+;2Fe3++H2S=2Fe2++S↓+2H+;
(3)根据上述分析,在溶液Y中通入空气可以将Fe2+氧化成Fe3+,再通入NH3后,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;若通入NH3后溶液的pH过高,Mg2+转化为Mg(OH)2沉淀,降低产品纯度,故答案为:将Fe2+氧化成Fe3+;产生红褐色沉淀;Mg2+转化为Mg(OH)2沉淀,降低产品纯度;
(4)操作Ⅱ是过滤,除用到玻璃棒外,还需要的玻璃仪器是:烧杯、漏斗,故答案为:烧杯、漏斗;
(5)滤渣Z中含有S、FeS2等,灼烧产生的尾气中含有二氧化硫气体,溶液X中含有的Fe3+能够将二氧化硫氧化生成硫酸,充分反应后溶液的酸性增强,pH减小,故答案为:减小;
(6)结晶水的质量为(m1-m2)g,则![]() =
=![]() ,解得x=
,解得x=![]() ,故答案为:
,故答案为: ![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
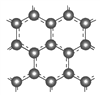
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
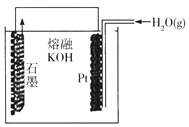
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。