题目内容
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.mol/L的Na2CO3溶液,滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是

A. Ksp(CaCO3)=5×10-10
B. Z点对应的分散系很稳定
C. W、x、y三点中,水的电离程度最大的为y点
D. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
【答案】C
【解析】A、当加入10mLNa2CO3溶液时,CaCl2与Na2CO3恰好完全反应,此时c(Ca2+)=c(CO32-)=10-4.3mol/L,Ksp(CaCO3)= c(Ca2+)·c(CO32-)=10-8.6(mol/L)2,选项A错误;B、Z点在曲线下方,Z点对应的分散系为悬浊液,悬浊液不稳定,选项B错误;C、由图知w、x、y三点中c(Ca2+)依次减小,溶液中c(CO32-):w<x<y,CO32-水解促进水的电离,溶液氢氧根离子全部来自水的电离,CO32-浓度越大溶液碱性越强,水的电离程度最大的为y点,选项C正确;D、CaSO4微溶于水,CaSO4的溶解度大于CaCO3,若用等浓度的Na2SO4溶液代替Na2CO3溶液,图像在点后的变化 应在实线下方,选项D错误。答案选C。

【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
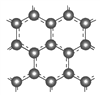
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
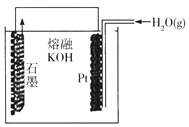
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。