题目内容
【题目】在一个恒温恒容的密闭容器中充入1 mol HI,建立如下平衡:2HI(气)![]() H2(气)+I2(气),测得HI的转化率为a%。保持恒温恒容,在上述平衡体系中再充入2molHI,待新平衡建立后HI的转化率为b%,则a与b的关系是
H2(气)+I2(气),测得HI的转化率为a%。保持恒温恒容,在上述平衡体系中再充入2molHI,待新平衡建立后HI的转化率为b%,则a与b的关系是
A.a>b B.a<b C.a=b D.无法确定
【答案】C
【解析】
试题分析:根据反应方程式H2(g)+I2(g)![]() 2HI(g)可知,方程式两边气体的体积不变,则压强不影响化学平衡,在一个容积固定的密闭容器中充入1molHI,达到平衡时HI的转化率为a%,再向该容器中充入1molHI,由于压强不影响化学平衡,则达到新的平衡时各组分的浓度增大为原先的2倍,而碘化氢的转化率一定不变,即:a%=b%,故选C.
2HI(g)可知,方程式两边气体的体积不变,则压强不影响化学平衡,在一个容积固定的密闭容器中充入1molHI,达到平衡时HI的转化率为a%,再向该容器中充入1molHI,由于压强不影响化学平衡,则达到新的平衡时各组分的浓度增大为原先的2倍,而碘化氢的转化率一定不变,即:a%=b%,故选C.

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是____________________,工业上选择500℃主要出于两方面考虑,一是__________,二是__________。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
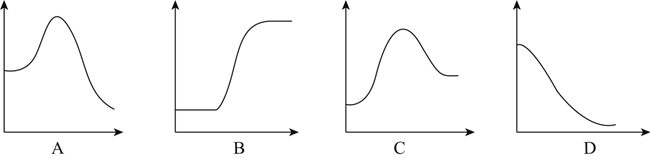
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是__________。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因____________________。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有______________________________。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式____________________、____________________。
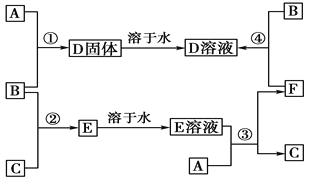
【题目】I.AG七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如下表所示:
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的最外层电子数与其电子层数相同,是地壳中含量多的金属元素 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它的某种氧化物具有磁性 |
G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
请回答下列问题:
(1)A在元素周期表中的位置是_______;F的原子结构示意图是_____________。
(2)下列事实能证明C和E的非金属性强弱的是_____。(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是______(填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:_______。
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:______。己知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:_________。
II.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
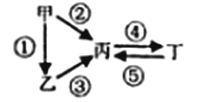
(1)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是________。写出乙→丙的化学方程式:__________。
(2)若丁物成质具有两性,②③反应均要用強碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:__________。室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6 mol·L-1,则该溶液的pH为______。
(丁的Ksp为1.3×10-33)