题目内容
【题目】某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯。
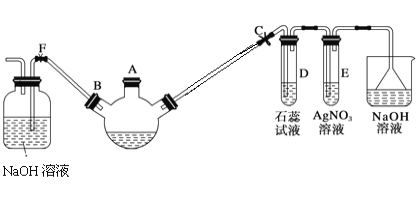
请分析后回答下列问题
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为
。
(2)D试管内出现的现象为 。
(3)E试管内出现的现象为 。
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是 。
(5)待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是 ____ 。
(6)反应结束后将三颈烧瓶中的溴苯分离实验方法是 。(铁屑已分离)
【答案】(1)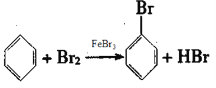
(2)紫色石蕊试液变红 (3)溶液中有淡黄色沉淀生成 (4)冷凝回流
(5)与F相连的广口瓶中NaOH溶液流入三颈烧瓶(只要答出该点就给2分) (6)分液
【解析】
试题分析:(1)在催化剂的作用下,苯和液溴发生取代反应生成溴苯,反应的化学方程式是
 。
。
(2)由于生成的溴化氢极易挥发,溶于水显酸性,则紫色石蕊试液变红。
(3)溴化氢溶于水和硝酸银反应生成溴化银淡黄色长的,即实验现象是溶液中有淡黄色沉淀生成。
(4)由于苯和液溴都是易挥发的,所以三颈烧瓶右侧导管除导气外还起的作用是冷凝回流作用。
(5)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是与F相连的广口瓶中NaOH溶液流入三颈烧瓶。
(6)溴苯不溶于水,分液即可得到溴苯。

【题目】苯是一种重要的化工原料,可利用苯合成许多有机物。工业上以苯为原料合成环己烷,方法主要是H2还原法:用苯和氢气在高温下发生加成反应,合成环己烷,如图所示。
![]()
(1)在T℃、2L的密闭容器中反应5min时,消耗标准状况下的H23360mL,用苯表示该反应速率为____________________。
(2)为了提高该反应中苯的转化率,除了可以适当改变反应温度与压强外,还可以采取的措施是____________________。
(3)工业上可用乙炔合成苯:3CH![]() CH(g)=C6H6(l) △H =-636kJ/mol,已知C2H2(g)的燃烧热为△H =-1300kJ/mol,请写出C6H6(l)燃烧热的热化学方程式:_______________________________ 。
CH(g)=C6H6(l) △H =-636kJ/mol,已知C2H2(g)的燃烧热为△H =-1300kJ/mol,请写出C6H6(l)燃烧热的热化学方程式:_______________________________ 。
上述反应若保持温度不变,在不同的压强下达到平衡,各成分的物质的量如下表所示:
起始(mol) | 达平衡(mol) | |||||||
装置编号 | 总压 | C6H6(g) | H2(g) | C6H12(g) | C6H6(g) | H2(g) | C6H12(g) | |
① | 10MPa | 1 | 2.8 | 0 | ||||
② | 20MPa | 1 | 2.8 | 0 | ||||
(4)下列事实能够说明装置①中反应达平衡的是___________________(填序号)。
a.气体总压强保持不变
b.单位时间内,每消耗0.15molH2,同时消耗0.05mol环己烷蒸汽
c.苯蒸气的质量保持不变
d.气体的平均摩尔质量保持不变
(5)达平衡时,H:2的物质的量①_____②(填“>”“<”或“=”),理由是___________________。
(6) 环己烷燃烧可放出大量的热,所以工业上可用环己烷作高效燃料电池,请写出环己烷(C6H12)碱性燃料电池负极的电极反应式:_____________________________________________。
(7)列式计算装置①中反应的平衡常数Kp=______________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。