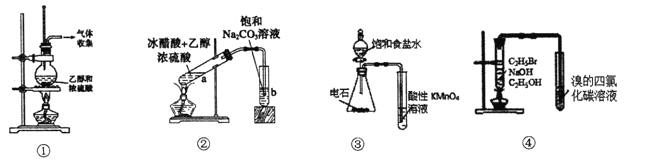
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的名称:A__________,C________。
(2)E元素原子的未成对电子数是________,E元素在周期表中位于第________周期______族;已知元素周期表可按电子排布分为s区、p区、d区等,则E元素在______区。
(3)画出D的核外电子排布图:_________。
【答案】硅 磷 4 四 Ⅷ d ![]()
【解析】
A、B、C、D是四种短周期元素, K层最多排列2个电子,所以x=2,A的原子结构示意图为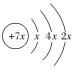 ,则A原子核内有14个质子,A为Si元素;A、B、C同一周期,B核外电子排布式为1s22s22p63s1,则B是Na元素,C的最外层有三个未成对电子,则C为P元素;C、D同主族,且D属于短周期元素,则D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子总数为:2+8+8+6+2=26,则E为Fe元素,据此解答。
,则A原子核内有14个质子,A为Si元素;A、B、C同一周期,B核外电子排布式为1s22s22p63s1,则B是Na元素,C的最外层有三个未成对电子,则C为P元素;C、D同主族,且D属于短周期元素,则D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子总数为:2+8+8+6+2=26,则E为Fe元素,据此解答。
根据上述分析可知A是Si元素;B是Na元素;C是P元素;D是N元素;E是Fe元素。
(1) A是Si元素,元素名称为硅;C是P元素,元素名称为磷;
(2)E为Fe元素,外围电子排布式是3d64s2,d能级轨道数目为5,同一轨道最多能容纳2个自旋方向相反的电子,原子核外各个能级上电子总是尽可能成单排列,而且自旋方向相同,这样能量最低,所以Fe元素原子的未成对电子数是4个;Fe原子序数是26,Fe在元素周期表中位于第四周期第VIII族,属于d区元素;
(3)D为N元素,N原子核外电子排布式为1s22s22p3,电子排布图为![]() 。
。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是

①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同