题目内容
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO3﹣的空间构型是______________________(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为____________.
②H2O 分子中O 原子轨道的杂化类型为____________.
③1mol CO2 中含有的σ键数目为__________________.
(3)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_______________________________________;
【答案】平面三角形 C≡O sp3杂化 2×6.02×1023个 第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
【解析】
(1)利用价层电子对互斥模型判断;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②根据中心原子形成的δ键和孤电子对数判断杂化类型;
③据CO2的结构式O=C=O判断;
(3)从一级电离得到的离子分析;
(1)![]() 中孤对电子
中孤对电子![]() ,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
答案为:平面三角形;
(2)N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O;
故答案为:C≡O;
②H2O 分子中O形成2个δ键,孤电子对数为![]() ,所以价层电子对数为4,则为sp3杂化;
,所以价层电子对数为4,则为sp3杂化;
故答案为:sp3;
③CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键的物质的量为2mol,数目为2×6.02×1023或2NA;
故答案为:2×6.02×1023;
(3) 酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以第一步电离程度大于第二步电离;
答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
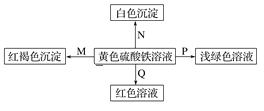
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 铁粉 | KSCN |
D | Na2O2 | MgCl2 | 锌粉 | KSCN |
A.AB.BC.CD.D
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
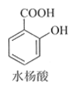 +(CH3CO)2O(醋酸酐)
+(CH3CO)2O(醋酸酐)![]()
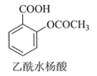 +CH3COOH
+CH3COOH
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | 72~ 74 | 135~138 |
相对密度/(g · cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右, 充分反应。稍冷后进行如下操作:
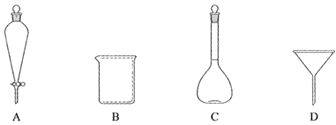
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。回答下列问题:
(1)该合成反应中应采用_____加热。(填标号)
A 热水浴 B 酒精灯 C 煤气灯 D 电炉
(2)下列玻璃仪器中,①中需使用的有_____(填标号)。
(3)①中需使用冷水,目的是_____。
(4)②中饱和碳酸氢钠的作用是_____,以便过滤除去难溶杂质。
(5)④采用的纯化方法为_____。
(6)本实验的产率是_____%。