题目内容
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
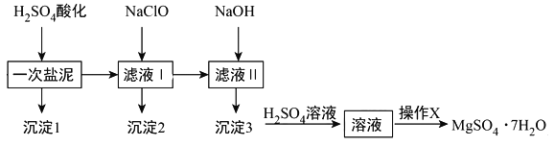
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和___________、____________.
(2)“操作X”是将溶液____________、____________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为_________________________________.
(4)检验滤液Ⅱ中是否含有Fe3+的实验方法是__________________________.
(5)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
【答案】烧杯 漏斗 蒸发浓缩(或加热浓缩) 冷却结晶(或降温结晶) Fe(OH)3或Fe2O3 Al(OH)3或Al2O3 ClO-+Mn2++H2O=MnO2+Cl-+2H+ 取滤液II 1-2mL于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+,反之若变为红色,则证明滤液Ⅱ中含有Fe3+ 98.4%
【解析】
一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,加入硫酸反应生成硫酸镁,硫酸钙,硫酸铁,硫酸铝,硫酸锰,会把碳酸盐和硅酸盐转化为溶于水的硫酸盐,得到的沉淀1主要为H2SiO3、CaSO4,过滤,滤液加入次氯酸钠是为了氧化锰离子为二氧化锰,同时溶液中Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,所以沉淀2为MnO2、Fe(OH)3、Al(OH)3,过滤,在滤液中加入氢氧化钠生成氢氧化镁沉淀,所以沉淀3为Mg(OH)2,氢氧化镁中加入硫酸得到硫酸镁溶液,将溶液经过加热浓缩,冷却结晶,过滤、洗涤、干燥等操作,获得MgSO47H2O晶体,据此分析作答。
(1)分离沉淀1与滤液I属于过滤操作,则所用到的玻璃仪器有玻璃棒、烧杯和漏斗,故答案为:烧杯;漏斗;
(2)硫酸镁溶液经过蒸发浓缩(或加热浓缩)、冷却结晶(或降温结晶)和过滤洗涤,即得到MgSO4·7H2O晶体,故答案为:蒸发浓缩(或加热浓缩);冷却结晶(或降温结晶);
(3)加入硫酸反应生成硫酸镁,硫酸铝,硫酸铁,加入次氯酸钠是为了氧化锰离子为二氧化锰,调节溶液pH,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,受热分解分别得到Fe2O3和Al2O3;NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,故答案为:Fe(OH)3或Fe2O3;Al(OH)3或Al2O3;Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(4)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取滤液II 1-2mL于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+,反之若变为红色,则证明滤液Ⅱ中含有Fe3+;
(5)准确称量制得的样品5g,用200mL水溶解,加入2molL-1的盐酸5mL,在不断搅拌下滴加足量2molL-1 BaCl2溶液,充分反应后,得沉淀4.66g,生成沉淀BaSO4物质的量=![]() =0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=
=0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=![]() ×100%=98.4%,故答案为:98.4%。
×100%=98.4%,故答案为:98.4%。

【题目】某同学设计下列实验装置进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是()

① | ② | ③ | ④ | |
A | 白色 | 先变红色后无色 | 橙色 | 蓝色 |
B | 无色 | 红色 | 橙色 | 紫色 |
C | 无色 | 白色 | 橙色 | 蓝色 |
D | 白色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |