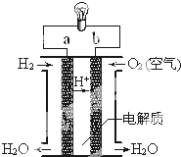
题目内容
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

【答案】1s22s22p63s23p63d10 ![]() sp3 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 水分子间存在氢键 Cu2+ + 4NH3= [Cu(NH3)4]2+或Cu2+ + 4NH3·H2O= [Cu(NH3)4]2++ 4H2O 8 4
sp3 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 水分子间存在氢键 Cu2+ + 4NH3= [Cu(NH3)4]2+或Cu2+ + 4NH3·H2O= [Cu(NH3)4]2++ 4H2O 8 4 ![]()
【解析】
X是所有元素中原子半径最小的,X为H元素;Y有三个能级,且每个能级上的电子数相等,Y为C元素;R与Y同一主族且原子序数小于30,则R为Si元素;X、Y、Z、W、R、I、Q的原子序数依次增大,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,Z为N元素,W为O元素;I的原子序数是W的两倍,I为S元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,Q为Cu元素。
(1)根据构造原理书写电子排布式和电子排布图。
(2)用价层电子对互斥理论判断杂化方式和空间构型。
(3)①Y、R的最高价氧化物分别为CO2、SiO2,CO2属于分子晶体,SiO2属于原子晶体,沸点:CO2<SiO2。
②W、I的简单氢化物分别为H2O、H2S,H2O的熔沸点比H2S高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(4)向CuSO4溶液中通入足量NH3,生成的深蓝色离子为[Cu(NH3)4]2+。
(5)用“均摊法”确定晶胞中原子数。由晶胞可看出配位数为4。根据晶体的密度计算1mol晶体的体积,晶胞边长计算晶胞体积,结合晶胞中原子数计算阿伏加德罗常数。
X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,X为H元素;Y有三个能级,且每个能级上的电子数相等,Y为C元素;R与Y同一主族且原子序数小于30,则R为Si元素;X、Y、Z、W、R、I、Q的原子序数依次增大,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,Z为N元素,W为O元素;I的原子序数是W的两倍,I为S元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,Q为Cu元素。
(1)Q为Cu,Cu原子核外有29个电子,根据构造原理,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu+的核外电子排布式为1s22s22p63s23p63d10;Y为C,基态C原子的核外电子排布式为1s22s22p2,电子排布图为![]() 。
。
(2)化合物ZX3为NH3,中心原子N的价层电子对数为![]() ×(5-3×1)+3=4,N原子为sp3杂化。ZW2-为NO2-,NO2-中中心原子N上的孤电子对数为
×(5-3×1)+3=4,N原子为sp3杂化。ZW2-为NO2-,NO2-中中心原子N上的孤电子对数为![]() ×(5+1-2×2)=1,σ键电子对数为2,N的价层电子对数为3,VSEPR模型为平面三角形,由于N上有1对孤电子对,NO2-的立体构型为V形。
×(5+1-2×2)=1,σ键电子对数为2,N的价层电子对数为3,VSEPR模型为平面三角形,由于N上有1对孤电子对,NO2-的立体构型为V形。
(3)①Y、R的最高价氧化物分别为CO2、SiO2,沸点较高的是SiO2,原因是:CO2属于分子晶体,SiO2属于原子晶体,分子间作用力远小于共价键的键能,所以沸点:CO2<SiO2。
② W、I的简单氢化物分别为H2O、H2S,H2O的熔沸点比H2S高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(4)向CuSO4溶液中通入足量NH3,生成的深蓝色离子为[Cu(NH3)4]2+,反应的离子方程式为Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O。
(5)Y为C元素,用“均摊法”,1个晶胞中含C原子数:8×![]() +6×
+6×![]() +4=8个;根据晶胞,C原子周围等距离最近的C原子有4个,C原子的配位数为4;1molC的质量为12g,1mol该晶体的体积为
+4=8个;根据晶胞,C原子周围等距离最近的C原子有4个,C原子的配位数为4;1molC的质量为12g,1mol该晶体的体积为![]() =
=![]() cm3,晶胞的边长为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则阿伏加德罗常数的数值为
cm3,晶胞的边长为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则阿伏加德罗常数的数值为![]() cm3÷(a3×10-30cm3÷8)=
cm3÷(a3×10-30cm3÷8)=![]() ×1030。
×1030。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D