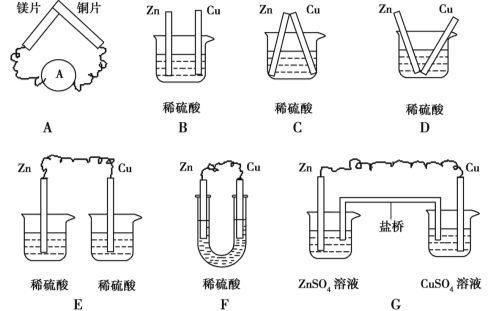
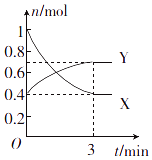题目内容
【题目】根据要求填空:
(1)相同物质的量的O2和O3的质量比 , 分子个数比为 , 所含氧原子的个数比为 .
(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为g.此溶液中Mg2+的物质的量浓度为mol/L,Cl﹣的物质的量浓度为mol/L.
【答案】
(1)2:3;1:1;2:3
(2)38;2;4
【解析】解:(1)依据n= ![]() =
= ![]() 可知,物质的量相等,物质的质量与摩尔质量成反正比;分子数与物质的量成正比,所以相同物质的量的O2和O3的质量比:32:48=2:3;分子数之比为:1:1;臭氧三原子分子、氧气双原子分,所以相同物质的量的O2和O3的所含氧原子的个数比为:1×2:1×3=2:2; 故答案为:2:3;1:1;2:3;(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为:2mol/L×0.2L×95g/mol=38g;氯化镁为强电解质,完全电离,1mol氯化镁含有1mol镁离子,2mol氯离子,氯化镁溶液中镁离子物质的量浓度等于氯化镁的物质的量浓度为:2 mol/L;氯离子物质量浓度等于氯化镁物质的量浓度2倍,为4 mol/L,
可知,物质的量相等,物质的质量与摩尔质量成反正比;分子数与物质的量成正比,所以相同物质的量的O2和O3的质量比:32:48=2:3;分子数之比为:1:1;臭氧三原子分子、氧气双原子分,所以相同物质的量的O2和O3的所含氧原子的个数比为:1×2:1×3=2:2; 故答案为:2:3;1:1;2:3;(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为:2mol/L×0.2L×95g/mol=38g;氯化镁为强电解质,完全电离,1mol氯化镁含有1mol镁离子,2mol氯离子,氯化镁溶液中镁离子物质的量浓度等于氯化镁的物质的量浓度为:2 mol/L;氯离子物质量浓度等于氯化镁物质的量浓度2倍,为4 mol/L,
故答案为:38;2; 4.
(1)依据n= ![]() =
= ![]() ,结合臭氧三原子分子、氧气双原子分子解答;(2)依据n=CV,m=nM,结合氯化镁为强电解质,完全电离,1mol氯化镁含有1mol镁离子,2mol氯离子解答.
,结合臭氧三原子分子、氧气双原子分子解答;(2)依据n=CV,m=nM,结合氯化镁为强电解质,完全电离,1mol氯化镁含有1mol镁离子,2mol氯离子解答.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应:2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/molL–1 | 物质的平衡浓度/molL-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 500 | 0.40 | 0.20 | 0 | 0.160 |
II | 500 | 0.80 | 0.40 | 0 | |
III | 800 | 0 | 0 | 0.20 | 0.050 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大