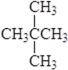题目内容
【题目】下列关于电解质溶液的叙述正确的是( )
A. 常温下电离常数为![]() 的酸HA溶液中
的酸HA溶液中![]()
B. 向0.1![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中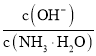 增大
增大
C. 将饱和![]() 溶液加入到饱和石灰水中,有白色沉淀产生,说明
溶液加入到饱和石灰水中,有白色沉淀产生,说明![]() 大于
大于![]()
D. 0.2![]() 溶液与0.1
溶液与0.1![]() 溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
【答案】D
【解析】
A.HA为弱酸,电离方程式为HAH++A-,电离平衡常数Ka=![]() ,c(H+)=
,c(H+)=![]() mol/L,故A错误;
mol/L,故A错误;
B.向0.1molL-1的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大抑制一水合氨电离,氢氧根离子浓度减小,一水合氨浓度增大,![]() 比值减小,故B错误;
比值减小,故B错误;
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明c(Ca2+)c(SO42-)≥Ksp(CaSO4),但不能说明Ksp[Ca(OH)2]大于Ksp(CaSO4),故C错误;
D.常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×0.1mol/L÷2=0.1mol/L,溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),代入计算得到:2c(OH-)+c(CH3COO-)=c(CH3COOH)+2c(H+),即2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确。
故选D。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
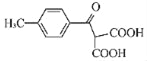
补充习题江苏系列答案【题目】某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程: 装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
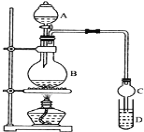
(1)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是________(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(2)球形干燥管的主要作用是_________________________。
(3)饱和Na2CO3溶液的作用是_______________________________________________________
II.提纯方法:①将D中混合液进行分离。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(4)第①步分离混合液时,选用的主要玻璃仪器的名称是_________________。
(5)第②步中用饱和食盐水洗去碳酸钠后、再用饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的__________________,______________。