题目内容
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是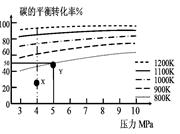
| A.上述正反应为吸热反应 |
| B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆 |
C.在5MPa、800K时,该反应的平衡常数为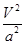 L2·mol-2 L2·mol-2 |
| D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因 |
AB
解析试题分析:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,正确;B、X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,正确;
C、此时碳转化率为50%
C(s)+2H2(g) CH4(g)
CH4(g)
始量 a 2a
转化量0.5a a 0.5a
平衡量0.5a a 0.5a
k="(0.5a/V)/" ( a/V)2=0.5V/a,错误;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,错误。
考点:考查化学平衡有关问题。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
| A.平衡向逆反应方向移动 | B.A的转化率降低 |
| C.m+n>p | D.C的体积分数减小 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是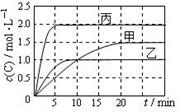
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
A.10min内甲容器中反应的平均速率: v(A) = 0.05mol·(L·min)-1
B.由图可知T1>T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂
COCl2(g) CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
已知4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是 ( )
| A.4/5v(NH3)=v(O2) | B.5/6v(O2)=v(H2O) | C.2/3v(NH3)=v(H2O) | D.4/5v(O2)=v(NO) |
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| C.达到化学平衡时,反应则停止进行 |
| D.当反应达到平衡时,每有3mol的H—H断裂,同时就有6mol的N—H键断裂。 |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
| D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |