题目内容
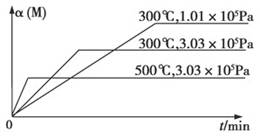
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| C.达到化学平衡时,反应则停止进行 |
| D.当反应达到平衡时,每有3mol的H—H断裂,同时就有6mol的N—H键断裂。 |
BD
解析试题分析:A.N2+3H2 2NH3反应是可逆反应,反应物可转化为生成物,生成物也可转化为反应物,所以反应物不能完全转化为生成物。错误。B.由于该反应是在体积恒定的密闭容器中发生的反应前后气体体积不等的反应。当反应达到化学平衡时,反应混合物中的任何成分N2、H2和NH3的物质的量浓度不再变化。正确。C.当反应达到化学平衡时,反应物还在反应产生生成物,生成物还在反应变为反应物,只是单位时间内任何物质消耗的浓度与产生的浓度相等,因此反应并未停止,任然在进行。错误。D.在任何时刻若有3mol的H—H断裂,就会有6mol的N—H键形成,同时有6mol的N—H键断裂。则相同的时间内N—H键形成与断裂数目相等,氨气的浓度不变,则反应达到平衡。正确。
2NH3反应是可逆反应,反应物可转化为生成物,生成物也可转化为反应物,所以反应物不能完全转化为生成物。错误。B.由于该反应是在体积恒定的密闭容器中发生的反应前后气体体积不等的反应。当反应达到化学平衡时,反应混合物中的任何成分N2、H2和NH3的物质的量浓度不再变化。正确。C.当反应达到化学平衡时,反应物还在反应产生生成物,生成物还在反应变为反应物,只是单位时间内任何物质消耗的浓度与产生的浓度相等,因此反应并未停止,任然在进行。错误。D.在任何时刻若有3mol的H—H断裂,就会有6mol的N—H键形成,同时有6mol的N—H键断裂。则相同的时间内N—H键形成与断裂数目相等,氨气的浓度不变,则反应达到平衡。正确。
考点:考查可逆反应的特点及化学平衡状态的判断的知识。

煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是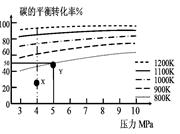
| A.上述正反应为吸热反应 |
| B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆 |
C.在5MPa、800K时,该反应的平衡常数为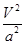 L2·mol-2 L2·mol-2 |
| D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s) + CO(g)  MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 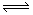 xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是( )
| A.该条件下此反应的化学平衡常数约为0.91 |
| B.A的平均反应速率为0.3mol/(L·s) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应: 3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
| A.若x=2,则p>0.5a | B.若x=3,则p<0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
| A.前2 min,D的平均反应速率为0.2 mol/(L·min) |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
 2C﹢D反应中,表示该反应速率最快的是( )
2C﹢D反应中,表示该反应速率最快的是( ) 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。