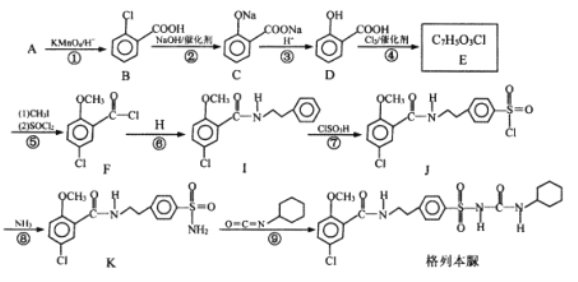
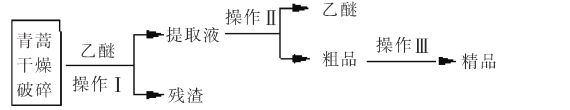
题目内容
【题目】W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述不正确的是( )
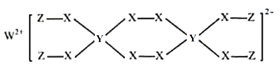
A.简单氢化物的稳定性:X>YB.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为弱酸D.该化合物中各元素均满足8电子稳定结构
【答案】D
【解析】
根据该化合物的结构可知W元素可以形成+2价阳离子,应为第IIA族元素,其原子序数最大,原子序数比其小的主族元素至少有3种,所以W应为第三周期元素,为Mg元素;X可以形成2个共价键,应为第ⅥA族元素,所以X为O元素,Z可以形成1个共价键,原子序数小于O,则Z为H元素,所以Y元素最外层电子数为6-1-2=3,所以Y为B元素。
A.Y为B元素,X为O元素,非金属性B<O,所以简单氢化物的稳定性B<O,故A正确;
B.O2-和Mg2+电子层结构相同,但O2-核电荷数更小,半径更大,故B正确;
C.B元素的最高价氧化物对应水化物为H3BO3,为弱酸,故C正确;
D.H元素最外层不满足8电子稳定结构,故D错误;
答案选D。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】次磷酸钠![]() 可用于化学镀镍。将黄磷
可用于化学镀镍。将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() ,
,![]() 是一种无色、有毒的可燃性气体,与
是一种无色、有毒的可燃性气体,与![]() 溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
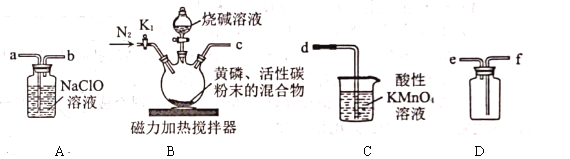
①装好药品,②连接装置,检查气密性,③打开![]() ,再通入一段时间
,再通入一段时间![]() ,④将反应所得的次磷酸钠分离出来,⑤关闭
,④将反应所得的次磷酸钠分离出来,⑤关闭![]() ,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开
,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开![]() 通入
通入![]() 一段时间。请回答下列问题:
一段时间。请回答下列问题:
(1)正确实验操作步骤的顺序是________(填序号)。
(2)实验装置中各导管口的连接顺序是________(填装置中的小写字母)。
(3)在黄磷中混入活性炭粉末的作用是________。
(4)先滴加烧碱溶液,再打开磁力加热搅拌器可能的原因是________。
(5)装置![]() 中反应的化学方程式是________。
中反应的化学方程式是________。
(6)![]() 和
和![]() 的溶解度
的溶解度![]() 如下:
如下:
|
| |
| 37 | 39 |
| 100 | 667 |
实验结束后,将A中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为________,然后________、冷却结晶、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(7)测定产品的纯度:取产品![]() 克配成
克配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,酸化后加入
于锥形瓶中,酸化后加入![]() 碘水于暗处充分反应得
碘水于暗处充分反应得![]() ,然后以淀粉溶液作指示剂,用
,然后以淀粉溶液作指示剂,用![]() 溶液滴定至终点,平均消耗
溶液滴定至终点,平均消耗![]() ,若其它杂质不参加反应,则产品纯度表达式为________。(已知:
,若其它杂质不参加反应,则产品纯度表达式为________。(已知:![]() )
)
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达平衡时,容器Ⅱ中CH3OCH3的浓度大于0.16 mol/L
C.达平衡时,容器Ⅲ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
D.若起始时向容器Ⅰ中充入CH3OH(g)0.30 mol、CH3OCH3(g)1.50 mol和H2O(g)0.30 mol,则反应将向逆反应方向进行