题目内容
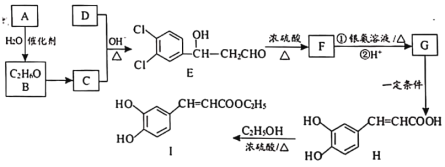
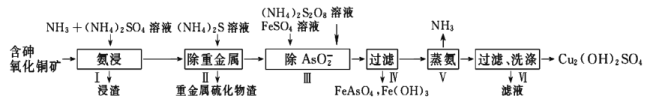
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:
(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
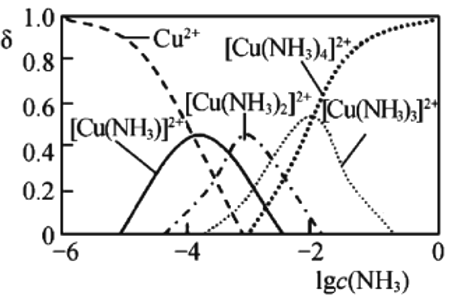
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
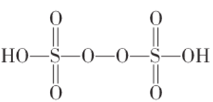
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
【答案】
![]() 温度过高,会加速NH3的挥发
温度过高,会加速NH3的挥发 ![]() +6 生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒
+6 生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒 ![]()
【解析】
含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]与氨气,硫酸铵反应生成![]() 、
、![]() 和水,加入硫化铵得到重金属硫化物渣和滤液,向滤液中加入硫酸亚铁和
和水,加入硫化铵得到重金属硫化物渣和滤液,向滤液中加入硫酸亚铁和![]() ,得到FeAsO4、Fe(OH)3和
,得到FeAsO4、Fe(OH)3和![]() ,
,![]() 蒸氨得到
蒸氨得到![]() 、氨气和硫酸铵。
、氨气和硫酸铵。
(1)过程中可循环利用物质是氨气,氨气的电子式是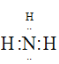 ;故答案为:
;故答案为: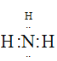 。
。
(2)①CuO被浸取时,CuO与氨气和硫酸铵反应生成水和![]() ,其离子方程式为
,其离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。
②氨气易挥发,因此浸取温度不宜超过55℃;故答案为:温度过高,会加速NH3的挥发。
③书写出反应方程式![]() ,根据方程式知a mol
,根据方程式知a mol![]() 全部浸出为
全部浸出为![]() 需要5amol NH3,根据图象,当lg c(NH3)=0时,
需要5amol NH3,根据图象,当lg c(NH3)=0时,![]() 物质的量分数为1,此时c(NH3)=1 molL1,因此原浸取液中起始时c(NH3)应满足的条件是
物质的量分数为1,此时c(NH3)=1 molL1,因此原浸取液中起始时c(NH3)应满足的条件是![]() ;故答案为:
;故答案为:![]() 。
。
(3)①已知![]() 结构式如图,左边的Sspan>—O单键,O—H键,说明O为-2价,S=O双键,O为-2价,过氧根中氧为-1价,根据此结构确定和化合价代数和为0,得到
结构式如图,左边的Sspan>—O单键,O—H键,说明O为-2价,S=O双键,O为-2价,过氧根中氧为-1价,根据此结构确定和化合价代数和为0,得到![]() 中S元素的化合价为+6;故答案为:+6。
中S元素的化合价为+6;故答案为:+6。
②![]() 需过量,与
需过量,与![]() 充分反应生成铁离子,
充分反应生成铁离子,![]() 氧化
氧化![]() 使之变为沉淀,另一目的是生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒;故答案为:生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒。
使之变为沉淀,另一目的是生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒;故答案为:生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒。
(4) “蒸氨”是![]() 受热反应生成氨气、硫酸铵和
受热反应生成氨气、硫酸铵和![]() ,反应的化学方程式为
,反应的化学方程式为![]() ;故答案为:
;故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】次磷酸钠![]() 可用于化学镀镍。将黄磷
可用于化学镀镍。将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() ,
,![]() 是一种无色、有毒的可燃性气体,与
是一种无色、有毒的可燃性气体,与![]() 溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
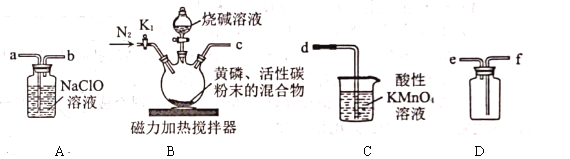
①装好药品,②连接装置,检查气密性,③打开![]() ,再通入一段时间
,再通入一段时间![]() ,④将反应所得的次磷酸钠分离出来,⑤关闭
,④将反应所得的次磷酸钠分离出来,⑤关闭![]() ,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开
,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开![]() 通入
通入![]() 一段时间。请回答下列问题:
一段时间。请回答下列问题:
(1)正确实验操作步骤的顺序是________(填序号)。
(2)实验装置中各导管口的连接顺序是________(填装置中的小写字母)。
(3)在黄磷中混入活性炭粉末的作用是________。
(4)先滴加烧碱溶液,再打开磁力加热搅拌器可能的原因是________。
(5)装置![]() 中反应的化学方程式是________。
中反应的化学方程式是________。
(6)![]() 和
和![]() 的溶解度
的溶解度![]() 如下:
如下:
|
| |
| 37 | 39 |
| 100 | 667 |
实验结束后,将A中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为________,然后________、冷却结晶、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(7)测定产品的纯度:取产品![]() 克配成
克配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,酸化后加入
于锥形瓶中,酸化后加入![]() 碘水于暗处充分反应得
碘水于暗处充分反应得![]() ,然后以淀粉溶液作指示剂,用
,然后以淀粉溶液作指示剂,用![]() 溶液滴定至终点,平均消耗
溶液滴定至终点,平均消耗![]() ,若其它杂质不参加反应,则产品纯度表达式为________。(已知:
,若其它杂质不参加反应,则产品纯度表达式为________。(已知:![]() )
)