题目内容
14. 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是D
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
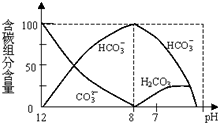
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)不能大量共存.
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-).
③已知在25℃时,CO32-水解反应的平衡常数Kh=$\frac{c(HC{O}_{3}^{-}).c(O{H}^{-})}{c(C{O}_{3}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10.
分析 (1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,得到溶液溶质为NaA和HA,溶液pH大于7,说明A-离子水解程度大于HA电离程度;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图象判断H2CO3、HCO3-、CO32-能否大量共存,
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,根据电荷守恒解答;
③水解常数Kh=$\frac{c(HC{O}_{3}^{-}).c(O{H}^{-})}{c(C{O}_{3}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,根据Kw计算出c(H+),再计算出溶液的pH.
解答 解:(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,反应后得到等量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离,
A. 水解生成HA,则c(HA)>c(A-),故A错误;
B.因等体积混合,则反应后c(HA)一定小于0.1mol/L,故B错误;
C.反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+$\frac{1}{2}$[c(HA)-c(A-)],故D正确;
故答案为:D;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中H2CO3、HCO3-、CO32-不能大量共存,
故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,根据电荷守恒可得:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-),
故答案为:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-);
③水解常数Kh=$\frac{c(HC{O}_{3}^{-}).c(O{H}^{-})}{c(C{O}_{3}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以溶液的pH=10,
故答案为:10.
点评 本题考查离子浓度大小比较,题目难度中等,涉及溶液中离子浓度大小分析、化学平衡常数的计算及溶液中酸碱之间的反应等知识,综合考查学生分析问题、解决问题的能力.

| A. | 测得容器内压强增大p%,A的转化率也是p% | |
| B. | 恒容容器内平衡后再充入A(g),此平衡逆向移动 | |
| C. | 恒容容器内平衡后再充入等量的A(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 | |
| D. | 恒压容器内平衡后再充入Ar(g),A的转化率不变 |
| A. | CH4 | B. | C3H8 | C. | C10H20 | D. | C5H12 |
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
| A. | Fe与H2SO4溶液 | B. | Fe与FeCl3溶液 | C. | Fe与HCl溶液 | D. | Fe与CuSO4 溶液 |
 中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题: 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O