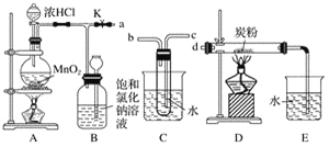
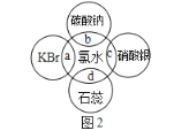
题目内容
【题目】恒温恒容时,在体积为0.5L的密闭容器中,进行NO2和N2O4之间发生反应N2O4(g)![]() 2NO2(g),如图所示。
2NO2(g),如图所示。
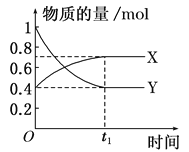
(1)曲线________(填“X”或“Y”)表示NO2的物质的量随时间变化的曲线。
(2)若升高温度,则υ(正)________(填“加快”或“减慢”,下同),υ(逆)________。
(3)若t1=10s,则用υ(NO2)=________
【答案】Y 加快 加快 0.12 mol/(L·s)
【解析】
(1)根据物质的量的变化量之比等于化学计量数之比分析;
(2)根据温度对反应速率的影响分析;
(3)根据速率的定义计算υ(NO2)。
(1)由方程式N2O4(g)![]() 2NO2(g)可知反应中N2O4与NO2变化的物质的量的比是1:2,NO2的物质的量变化较大,则根据图象可知Y表示NO2的物质的量随时间的变化曲线;
2NO2(g)可知反应中N2O4与NO2变化的物质的量的比是1:2,NO2的物质的量变化较大,则根据图象可知Y表示NO2的物质的量随时间的变化曲线;
(2)温度升高,正、逆反应速率都加快,与反应是放热反应还是吸热反应无关,υ(正)加快,υ(逆)加快;
(3)由图象可知:在10s内NO2物质的量由开始的1mol变为0.4mol,△n(NO2)=0.6mol,反应在0.5L的密闭容器内进行,则用υ(NO2)表示反应速率为υ(NO2)=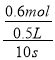 =0.12 mol/(L·s)。
=0.12 mol/(L·s)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目