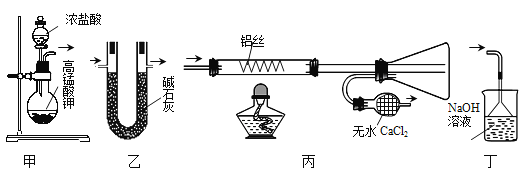
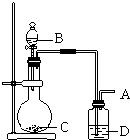
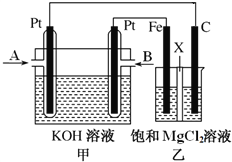
��Ŀ����
����Ŀ��ǰ������Ԫ��A��B��C��D��Eԭ����������������֪��A��Cͬ���壬A��ԭ�������������Ǵ�����3����B���������������ǿ�ᣬ��������ǿ�D��ԭ�Ӱ뾶�ǵ�3��������С�ģ�E���γɹ��������ݵ���ҪԪ�أ���E�����ܺ�ˮ��Ӧ�������з����������
A. A�����ӽṹʾ��ͼΪ![]()
B. D������������ˮ��������Դ���C������������ˮ���������
C. E��D�γɵ����ӻ�����ED2�ĵ���ʽΪ![]()
D. B��������Ϊ���ӻ����ֻ�����Ӽ����侧��Ϊ���Ӿ���
���𰸡�C
��������ǰ������Ԫ��A��B��C��D��Eԭ����������������֪��A��Cͬ���壬A��ԭ�������������Ǵ�����3������A��2�����Ӳ㣬����������Ϊ6����AΪ��Ԫ�أ�A��Cͬ���壬��CΪ��Ԫ�أ�B���������������ǿ�ᣬ��������ǿ�BΪAlԪ�أ�D��ԭ�Ӱ뾶�ǵ�����������С�ģ���DΪClԪ�أ�E���γɹ��������ݵ���ҪԪ�أ���E�����ܺ�ˮ��Ӧ��EΪCaԪ�ء�
A��A������O2���ĺ��������Ϊ10���ṹʾ��ͼΪ![]() ����A��ȷ��B���ǽ�����Cl��S��������HClO4��H2SO4��D������������ˮ��������Դ���C������������ˮ��������ԣ���B��ȷ��C��E��D�γɵ����ӻ�����CaCl2�ĵ���ʽΪ��
����A��ȷ��B���ǽ�����Cl��S��������HClO4��H2SO4��D������������ˮ��������Դ���C������������ˮ��������ԣ���B��ȷ��C��E��D�γɵ����ӻ�����CaCl2�ĵ���ʽΪ��![]() ����C����D��AlΪ���ý�����Al��������Al2O3Ϊ���ӻ����ֻ�����Ӽ����侧��Ϊ���Ӿ��壬��D��ȷ����ѡC��
����C����D��AlΪ���ý�����Al��������Al2O3Ϊ���ӻ����ֻ�����Ӽ����侧��Ϊ���Ӿ��壬��D��ȷ����ѡC��