题目内容
【题目】将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体.原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
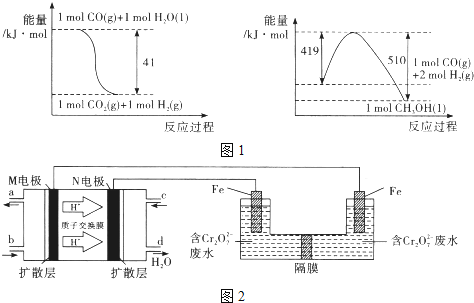
(1)由图1所示的能量变化,写出将CO2转化为甲醇的热化学方程式_____________。
(2)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入1moICO2、4molH2,达到平衡时H2与CO2的物质的量之比为8 :1 , CO2的转化率是_____________.
(3)以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2O72-)时,实验室利用图2装置模拟该法:
①M区发生反应的电极反应式为___________。
②己知电解池溶液里以Cr2O72-转化为Cr3+,该反应的离子方程式________________。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当Cr3+沉淀完全,溶液的pH_______________。(己知Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3) 。
【答案】(1)CO2(g)+3H2(g)=CH3OH(g)+H2O(l) △H=-50kJ/mol;
(2)80%;
(3)①CH3OH+H2O+6e-=CO2↑+6H+;②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)5.6;
【解析】
试题分析:(1)根据图1中能量变化,可得热化学方程式为:
①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
根据盖斯定律,②-①可得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)假设转化的CO2为xmol,由方程式可知转化的氢气为3xmol,故平衡时CO2为(1-x)mol、氢气为(4-3x)mol,平衡时H2与CO2的物质的量之比为8:1,则(4-3x):(1-x)=8:1,解得x=0.8,故CO2的转化率是![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,电极反应式为:CH3OH+H2O-6e-═CO2↑+6H+,故答案为:CH3OH+H2O-6e-═CO2↑+6H+;
②电解池溶液里Cr2O72-转化为Cr3+,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,同时生成水,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)溶液中c(Cr3+)=l0-5mol/L时沉淀完全,Ksp[Cr( OH)3]=c(Cr3+)×c3(OH-)=6.4×l0-31,则溶液中c(OH-)=4×l0-9,故溶液中c(H+)=![]() mol/L=2.5×l0-6mol/L,则pH=-lgc(H+)=5.6,故答案为:5.6。
mol/L=2.5×l0-6mol/L,则pH=-lgc(H+)=5.6,故答案为:5.6。

 名校课堂系列答案
名校课堂系列答案