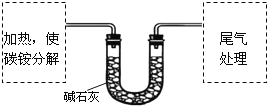
题目内容
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NC13) 。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(2) NH2Cl中氯元素的化合价为_______,其电子式为________。
(2) NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为___________。
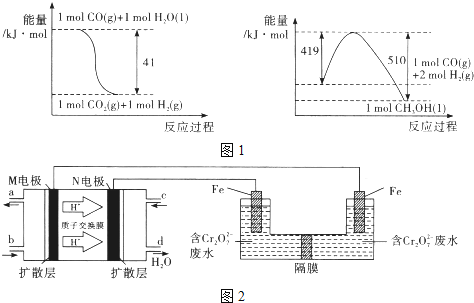
(4)已知:
2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
NH3(g)+3Cl2(g)=NC13(g)+3HCl(g) △H3
则△H3=_________ kJ·mol-1。
【答案】(1)+1;![]() ;
;
(2)NH2Cl+2H2O![]() NH3·H2O+HClO(或NH2Cl+H2O
NH3·H2O+HClO(或NH2Cl+H2O![]() NH3+HClO,水解方程式中“
NH3+HClO,水解方程式中“![]() ”写成“=”不扣分) ;
”写成“=”不扣分) ;
(3)0.06;(4)+25.5
【解析】
试题分析:(1)N元素是-3价,则根据正负价代数和为0可知 NH2Cl中氯元素的化合价为+1价,其电子式为![]() 。
。
(2) NH2Cl水解生成氨水和次氯酸,其水解的离子方程式为NH2Cl+2H2O![]() NH3·H2O+HClO。
NH3·H2O+HClO。
(3)三氯胺中氯元素是+1价,反应后变为-1价,所以0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为0.01mol×6=0.06mol。
(4)已知:① 2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
② N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
则根据盖斯定律即得到反应2NH3(g)+3Cl2(g)=NC13(g)+3HCl(g)的△H3=+25.5 kJ·mol-1。

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
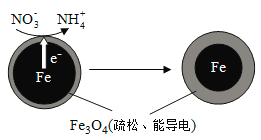
①作负极的物质是________。
②正极的电极反应式是_________。
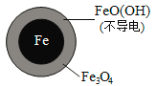
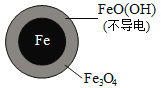
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。