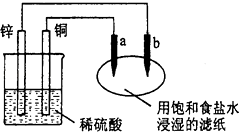
题目内容
【题目】Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8![]() Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
【答案】(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全);
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag;
(3)0.91.
【解析】试题(1)检验是否洗涤完全,可取最后一次滤液,检验溶液中是否含有SO42﹣或OH﹣,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全),
故答案为:取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全);
(2)电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,反应还应有KOH参加,反应的方程式为Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag;
(3)n(O2)=![]() =1.000×10﹣2mol,
=1.000×10﹣2mol,
设样品中Ag2O2的物质的量为x,Ag2O 的物质的量为y
248 g/mol×x+232g/mol×y=2.588g
x+![]() =1.000×10﹣2mol
=1.000×10﹣2mol
x=9.500×10﹣3mol
y=1.000×10﹣3mol
w(Ag2O2)=![]() =
=![]() =0.91.
=0.91.
答:样品中Ag2O2的质量分数为0.91.

 阅读快车系列答案
阅读快车系列答案【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=206.1kJmol﹣1
②CH4(g)+CO2(g)2CO(g)+2H2(g)△H2=247.3kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . 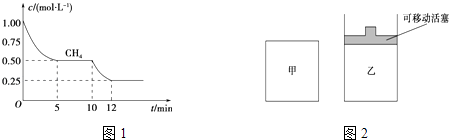
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变. ①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3= kJmol﹣1 . 800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发