题目内容
19.(1)下列是钠、碘、金刚石、锌、氟化钙晶体的晶胞图(未按顺序排序).与冰的晶体结构相符的是D(请用相应的编号填写).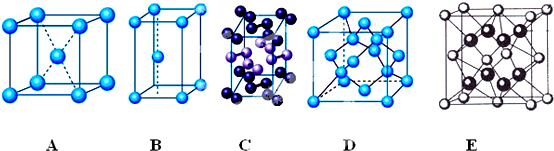
(2)写出丙醛与新制氢氧化铜悬浊液反应的化学方程式:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O.
分析 (1)冰是分子晶体,冰的构成微粒是分子,利用晶胞图来判断晶体的构成微粒;
(2)丙醛和新制氢氧化铜悬浊液在加热条件下发生氧化反应生成丙酸、氧化亚铜和水.
解答 解:(1)冰属于分子晶体,构成微粒为水分子,由晶胞图可知,钠为简单立方堆积、碘分子含有两个原子且碘为分子晶体、金刚石中每个C原子形成四个共价键、氟化钙为离子晶体且钙离子配位数是8、锌是六方最密堆积,所以A为Na的晶胞、B是锌的晶胞、C是碘的晶胞、D是金刚石晶胞、E是氟化钙晶胞,冰是分子晶体,构成微粒是分子,但每个O原子能和两个H原子形成两个共价键、和另外两个H原子形成氢键,所以每个O原子和四个H原子形成正四面体结构,与金刚石结构相似,故选D;
(2)丙醛和新制氢氧化铜悬浊液在加热条件下发生氧化反应生成丙酸、氧化亚铜和水,反应方程式为CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O,
故答案为:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O.
点评 本题考查化学方程式的书写、晶体类型判断,为高频考点,明确物质性质及晶体构成微粒是解本题关键,熟记有代表性物质晶胞结构及其配位数,题目难度中等.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
6.根据下面的信息,下列叙述不正确的是( )


| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
10.下列物质中不属于天然高分子化合物的是( )
| A. | 纤维素 | B. | 淀粉 | C. | 蛋白质 | D. | 麦芽糖 |
7.下列物质中,能使酸性高锰酸钾溶液褪色的是( )
| A. | CH4 | B. | CH2=CH2 | C. | CH3CH3 |
14.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液.若加入乙醇将析出深蓝色晶体.下列说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 | |
| C. | 沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ | |
| D. | 加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体 |
4.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
11.下列关于化学键和分子间作用力的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 一种物质只含两种非金属元素,该物质中一定没有非极性供价键 | |
| D. | 氢键属于分子间作用力,不属于化学键 |
8.在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ | ||
| C. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$、 |