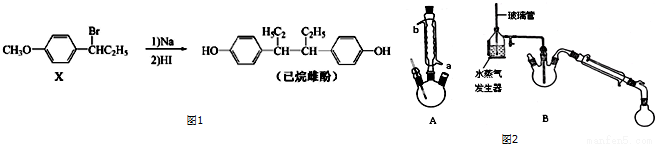
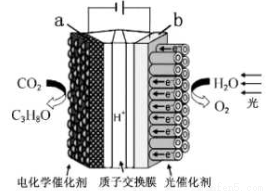
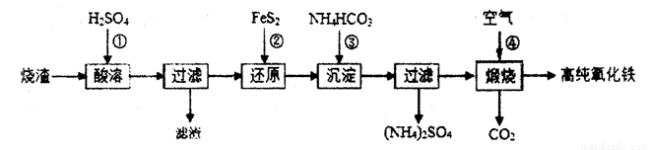
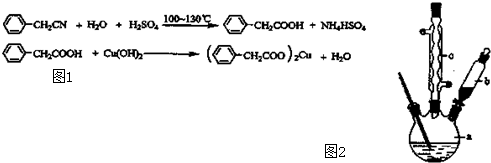
题目内容
11.回答下列关于物质的量的问题.(1)在质量分数为28%的KOH水溶液中,OH-与H2O分子数之比为1:8;
(2)在KCl和CaCl2组成的混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为2:1,该混合物中CaCl2的质量分数为33.3%.;
(3)由1mol HNO3和2mol H2SO4组成的混合物中所含的氢元素与氧元素的质量之比为5:176.
分析 (1)设质量分数为28%的氢氧化钾溶液质量为100g,则KOH为28g,水为72g,根据n=$\frac{m}{M}$计算KOH和水的物质的量,依据N=nNA计算;
(2)在KCl与CaCl2的混合物中,K+与Ca2+的物质的量之比为2:1,根据化学式知,KCl与CaCl2的物质的量之比为2:1,据此计算KCl的质量分数、氯化钙的物质的量分数;
(3)根据物质的分子构成原子种类,根据m=nM来计算含有的元素质量之比.
解答 解:(1)设质量分数为28%的氢氧化钾溶液质量为100g,则KOH为28g,水为72g,n(H2O)=$\frac{m}{M}$=$\frac{72g}{18g/mol}$=4mol,n(OH-)=n(KOH)=$\frac{m}{M}$=$\frac{28g}{56g/mol}$=0.5mol,N=nNA,则氢氧根和水分子分子数之比为0.5mol:4mol=1:8,
故答案为:1:8;
(2)在KCl与CaCl2的混合物中,K+与Ca2+的物质的量之比为2:1,根据化学式知,KCl与CaCl2的物质的量之比为2:1,KCl的质量分数=$\frac{74.5×2}{74.5×2+111}$×100%=57.3%;
KCl与CaCl2的物质的量之比为2:1,所以氯化钙的物质的量分数=$\frac{1}{2+1}$×100%=33.3%.
故答案为:2:1;33.3%;
(3)1mol HNO3和2mol H2SO4组成的混合物中,所含的氢原子是5mol,质量是5g,氧元素的物质的量是11mol,质量是176g,所以氢元素与氧元素的质量之比为5:176.
故答案为:5:176.
点评 本题考查物质的量的有关计算,侧重学生计算能力的考查,注意把握有关计算公式即可解答,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 溶液和胶体可以用丁达尔效应区分 | |
| B. | 将NaOH溶液与FeCl3溶液混合可制成Fe(OH)3胶体 | |
| C. | 鸡蛋白溶液、淀粉溶液、雾都是常见的胶体 | |
| D. | 溶液、胶体和浊液的本质区别是分散质微粒直径的大小 |
| A. | H2还原CuO的反应只属于还原反应 | |
| B. | 置换反应都是氧化还原反应,所以3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2既是置换反应又是氧化还原反应 | |
| C. | 3O2$\frac{\underline{\;电火花\;}}{\;}$2O3是氧化还原反应 | |
| D. | 复分解反应一定不是氧化还原反应 |
 CH3COOCH2CH3+H2O,属于酯化(取代)反应.
CH3COOCH2CH3+H2O,属于酯化(取代)反应.