题目内容
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |
C
解析

练习册系列答案
相关题目
有关下图装置的说法中正确的是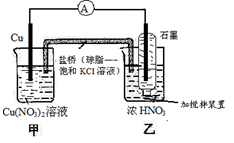
| A.氧化剂与还原剂必须直接接触,才能发生反应 |
| B.乙池中电极反应式为NO3-+4H+ + e-=NO2↑+2H2O |
| C.当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D.当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12LO2,将使气体全部溶于水 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是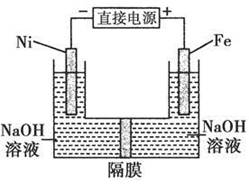
A.铁是阳极,电极反应为Fe-6e-+4H2O= +8H+ +8H+ |
| B.镍电极上的电极反应为2H++2e-=H2↑ |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
某化学学习小组学习电化学后,设计了下面的实验装置图:
下列有关该装置图的说法中正确的是
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O
⑤杂质碳被氧化
| A.只有①和② | B.只有②③④ |
| C.①②③④ | D.①②③④⑤ |
把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将
所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A.H2 | B.Ag | C.Cl2 | D.O2 |
关于镀铜和电解精炼铜,下列说法中正确的是( )
| A.都用粗铜作阳极、纯铜作阴极 |
| B.电解液的成分都保持不变 |
C.阳极反应都只有Cu-2e- Cu2+ Cu2+ |
D.阴极反应都只有Cu2++2e- Cu Cu |
用惰性电极进行电解,下列说法正确的是( )
| A.电解稀硫酸,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是( )
| A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动 Cr2O72-+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nk/nCr)为d,则此时铬酸钾的转化率为1- |